Жизнь — это боль, и иногда, увы, совсем не метафорическая. Некоторым пациентам приходится вести с ней постоянную и почти безнадежную борьбу. Для этого в ход идут любые средства, даже такие опасные, как опиоидные анальгетики, известные массой побочных эффектов. Но в последние годы ученые и медики приближаются к тому, чтобы в корне изменить природу этих анальгетиков, «отменив» их негативное действие, но сохранив обезболивающее.
Любая боль требует ответных действий. Но боль хроническая, нестерпимая, как у некоторых онкологических больных, может не откликаться на прием обычных анальгетиков из аптечки. Это вынуждает принимать исключительно сильные по своему обезболивающему эффекту препараты, опиоидные анальгетики, такие как морфин и его производные.
Первооткрывателем морфина стал потомственный фармаколог Фридрих Сертюрнер, который с юных лет увлеченно экспериментировал в семейной, а затем и в придворной лаборатории в Вестфалии. Опий, таинственное снадобье из сказок «Тысячи и одной ночи», химик начала XIX века никак не мог обойти вниманием. Выделив чистый препарат, Сертюрнер опробовал его на первых попавшихся собаках, а затем и на себе самом. Вещество погружало всех в глубокое, бесчувственное забытье с яркими видениями и было названо морфином в честь греческого бога сна. Его дальнейшая история знакома всем: от широкого использования и всеобщих восторгов — до злоупотреблений и суровых законодательных ограничений.
Милость сменилась запретами неспроста: у людей, вынужденных принимать опиоидные анальгетики, быстро развиваются тяжелые, а часто и опасные побочные эффекты, вплоть до полной остановки дыхания. Это заставляет тщательно оценивать целесообразность применения опиоидов, требует контроля за их оборотом и резко снижает доступность обезболивающих для тех, кто по‑настоящему в них нуждается. Так проявляется «двойственная» природа опиоидов, берущая начало в биохимии и физиологии их действия на нервную систему и весь организм.
Обоюдоострый меч
Все эффекты опиоидов связаны с воздействием на соответствующие рецепторы нервных клеток. Сегодня их известно пять видов, самые изученные — мю- (μ), дельта- (δ) и каппа- (κ) рецепторы, которые обнаруживаются в нейронах головного и спинного мозга, желудочно-кишечного тракта и в некоторых других органах. Любой опиоид взаимодействует с разными их типами, хотя у каждого есть свои «любимчики». Например, для самого морфина ключевыми являются μ-рецепторы.
| Локализация | Эффекты |
|---|---|
| Мю (М) | |
| головной мозг (кора, таламус и др.), спинной мозг, периферические чувствительные нейроны, ЖКТ | анельгезия, эйфория, миоз, ослабление кишечной перистальтики, физическая зависимость |
| Дельта (δ) | |
| головной мозг (мост, миндалина, зрительный бугор и др.), периферические чувствительные нейроны | анальгезия, антидепрессантное действие, физическая зависимость |
| Каппа (κ) | |
| головной мозг (гипоталамус, ограда и др.), спинной мозг, периферические чувствительные нейроны | анальгезия, миоз, седация (тормозящее и снотворное действие), дисфория (угнетенное состояние) |
Обнаружение опиодных рецепторов заставило задуматься, какую роль они выполняют без препаратов морфия. Такие вопросы привели к открытию энкефалинов и эндорфинов, «эндогенных опиоидов», которые выделяются самим мозгом. Это своего рода встроенная система защиты от боли, от тяжелых переживаний и невзгод. Эндогенные опиоиды, так же как и экзогенные, связываются с опиоидными рецепторами и проявляют анальгезирующий эффект.
Открытие эндорфинов вызвало почти эйфорию: была предпринята масса попыток получить их синтетические аналоги, вещества, которые оставались бы мощными анальгетиками, но не были бы отягощены массой неблагоприятных последствий. К сожалению, успехом эти поиски не увенчались: либо обезболивающее действие было слабым по сравнению с опиоидами извне, либо побочные эффекты слишком сильными — все аналоги оказались ничем не лучше того же морфина. Чтобы понять, почему это произошло, придется разобраться, как же работают опиоидные рецепторы.
Новое звено
Связываясь с лигандом (эндорфином, опиатом или другим сходным веществом), μ-рецептор меняет свою форму, запуская целый каскад внутриклеточных реакций. При этом сам рецептор становится субстратом для действия ферментов-протеинкиназ, которые модифицируют (фосфорилируют) некоторые из его аминокислот. Такой измененный рецептор связывает уже другие белки — бета-аррестины. Считается, что именно они виновны в развитии опасных побочных эффектов. Показано, что у мышей, генетически неспособных производить бета-аррестины, введение морфина вызывало обезболивание без угнетения дыхания, пищеварения и других опасных эффектов.
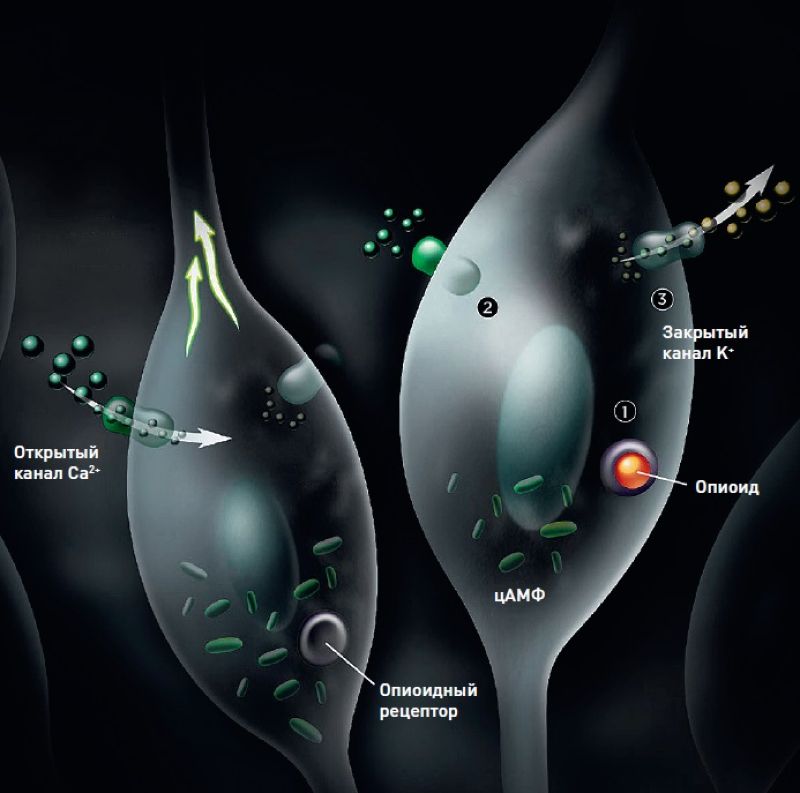
Активация опиоидного рецептора на мембране нейрона блокирует поступление в клетку ионов кальция и при этом стимулирует выведение из нее калия. Это приводит к гиперполяризации зарядов на мембране, тормозя возбуждение нейрона.
Бета-аррестины представлены в клетках всех тканей нашего тела и всегда связаны с работой мембранных рецепторов, активируя или подавляя их действие. Почему это может приводить к подавлению дыхания и перистальтики и к другим неприятным эффектам, до сих пор точно неизвестно. На этот счет существуют лишь гипотезы, причем все они не исключают друг друга, и в организме, возможно, разные варианты реализуются одновременно.
Самая популярная гипотеза (и самая недавняя по времени появления) предполагает, что рецептор, опиоид и бета-аррестин образуют общий тройной комплекс. Этот комплекс запускает каскад регуляторных процессов, которые меняют активность отдельных генов и белков. Прежде всего это сказывается на работе ионных каналов, которые выкачивают из клетки калий. Стремительная потеря калия вызывает гиперполяризацию клеточной мембраны; в таком состоянии клетка не способна к генерации потенциала действия и проведению импульсов. Происходит торможение всех процессов, в которые она вовлечена. Например, нейрон перестает отвечать на сигналы от путей, проводящих болевые импульсы, и в конечном итоге блокирует возникновение болевого эффекта. Так клетка участвует в обезболивании, а потеряв заодно чувствительность к другим сигналам, создает и побочные эффекты.
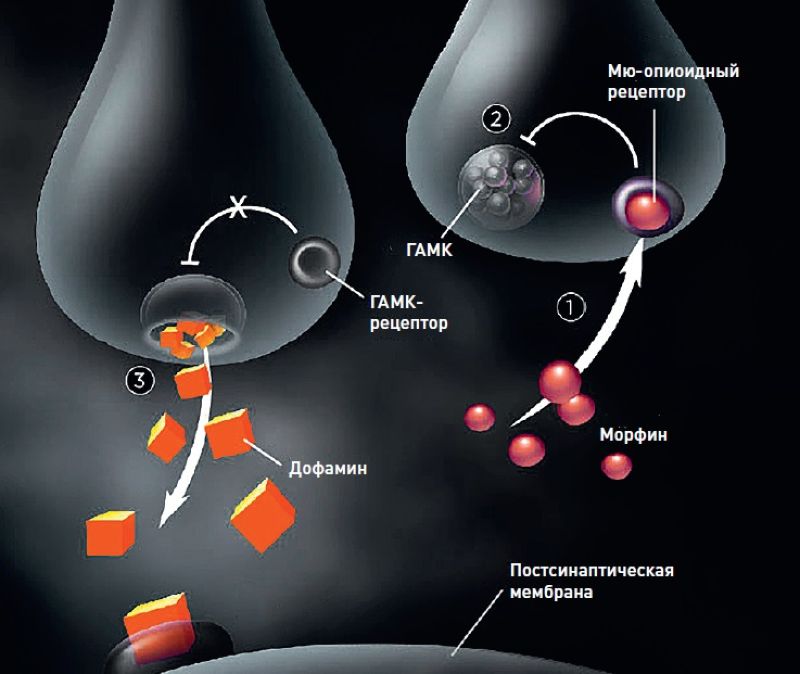
Активация опиоидных рецепторов в нейронах прилежащего ядра мозга ведет к выбросу молекул гамма-аминомасляной кислоты (ГАМК). Это заставляет соседние клетки выделять другой нейромедиатор, дофамин, приводящий к возникновению эйфории.
Молекула из машины
Долгожданный прорыв в поиске «золотой пули против боли» принесло компьютерное моделирование. Американские ученые из команды нобелевского лауреата Брайана Кобилки получили больше 3 млн виртуальных молекул, структурно подходящих для связывания с μ-рецептором. Шаг за шагом отбирая самые перспективные варианты, исследователи сократили их число до 2500, затем до 23 и, наконец, всего до семи соединений, которые демонстрировали самое высокое сродство к μ-рецептору. Фаворитом этой гонки оказалась молекула PZM21. Запомните ее название — возможно, это будущая знаменитость мирового масштаба.
PZM21 не только соединяется с μ-рецептором, но и меняет его конформацию так, что даже после фосфорилирования бета-аррестин не способен связаться с ним. Это приводит к позитивному терапевтическому эффекту (обезболиванию), причем побочные эффекты в виде угнетения дыхания, снижения перистальтики ЖКТ, физической и психической зависимости исчезают. Оценив воздействие PZM21 на лабораторных животных, ученые обнаружили, что новая молекула оказывает обезболивающее действие даже быстрее морфина — уже через 15 минут против 30. При этом морфин, как всегда, приводил к апноэ, а PZM21 на дыхательный ритм не влияла.
Кандидат номер один
Перспективный препарат олицеридин (TRV130), по заявлению создателей, может оказаться даже лучшим анальгетиком, чем сам морфин: его обезболивающий эффект начинается уже через пару минут после введения. На сегодня TRV130 остается единственным аналогом морфина, который был испытан на людях. Сейчас он находится на третьей фазе клинических испытаний, результаты которых должны стать известны уже в нынешнем году. Впрочем, слишком обнадеживаться не стоит. Во‑первых, есть некоторые поводы подозревать, что TRV130 все-таки вызывает угнетение дыхания. Во‑вторых, известно немало примеров, когда столь же многообещающие разработки заканчивались ничем. Достаточно вспомнить историю дезоморфина, более известного под названием героин.
Очень важно, что проблему адекватного обезболивания ученые пытаются решить, двигаясь совершенно разными путями. И пока одни моделируют и испытывают новые молекулы, другие пытаются «доработать» уже существующие. Такую надежду дает открытие особой группы эндогенных опиоидов, коротких пептидов эндоморфинов. Работы прошлого года показали хорошие перспективы для получения модифицированных эндоморфинов, которые воздействуют на μ-рецепторы, запуская обезболивание без побочных эффектов.
Конечно, говорить о получении заветных молекул пока еще рановато. Даже Брайан Кобилка и его соавторы замечают, что PZM21 и создаваемые ею эффекты нуждаются в дополнительных и всесторонних исследованиях, равно как и «аналоги» эндорфинов. Необходимо выяснить метаболические превращения, которые вещество претерпевает в человеческом организме, удостоверить положительные эффекты и отсутствие отрицательных. На все это уйдет еще не один год. Но по крайней мере ученые создали хорошую основу для дальнейших открытий, а больные и врачи получили новую надежду.
Источник https://www.popmech.ru/




