Здание компании Novartis в Базеле, Швейцария. В этом году созданный ею препарат показал успехи в борьбе с рассеянным склерозом.
Предлагаем вашему вниманию обзор самых главных, интересных и прорывных событий «большой фармы» за второе полугодие 2016 года.
Новые лекарства, одобренные FDA
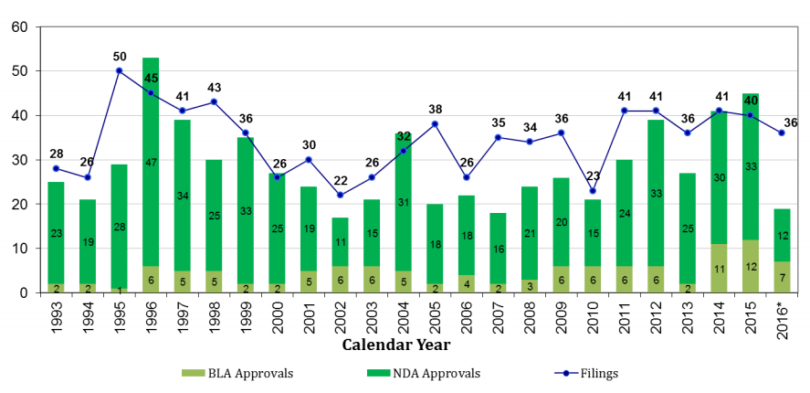
В этом году управление FDA зарегистрировало удивительно мало препаратов — всего 21, что особенно контрастирует с прошлогодним показателем в 45 новых лекарств. Так мало агентство не одобряло с 2007 года. Как видно из доклада FDA, это объясняется как меньшим количеством поданных заявок по сравнению с прошлым годом, так и большим количеством отклонённых, в основном по причине недостатков в производстве (примеси, стабильность, воспроизводимость аналитических параметров), а не самих препаратов. При этом США продолжают оставаться лидером по количеству одобренных новых лекарств — 65% впервые зарегистрированных лекарств одобряются в США. Из 19 одобренных лекарств 7 — с уникальным механизмом действия.
Среди них:
- Лекарство для лечения некоторых видов хронической лимфоцитарной лейкемии — Venclexta (ингибитор белка Bcl-2, который блокирует апоптоз раковых клеток),
- Новое моноклональное антитело для лечения рассеянного склероза — Zinbryta (оно связывается с рецептором интерлейкина-2 и тем самым снижает активность T-клеток),
- Лекарство для лечения редкого заболевания печени — первичного билиарного холангита — Ocaliva (связывается с рецепторами на клетках печени и ускоряет отток желчи из печени),
- Средство для терапии синдрома сухого глаза Xiidra (связывается с белком на поверхности лейкоцитов и препятствует их проникновению в роговицу, тем самым снижая воспаление),
- Антитело Zinplava — для снижения частоты кишечных инфекций, вызванных Clostridium diffifcile,
- И, наконец, самый противоречивый препарат года Exondys 51 (eteplirsen) компании Sarepta Therapeutics, о котором мы писали ранее (подробности см. ниже).
Крупнейший успех в области вторично-прогрессирующего рассеянного склероза
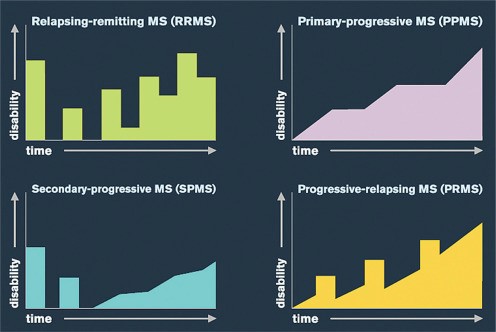
Рассеянный склероз (РС) — заболевание головного и спинного мозга, при котором проводящие отростки нейронов — аксоны — из-за неправильной работы иммунной системы лишаются своих миелиновых оболочек, то есть, как бы остаются без изоляции, перестают выполнять свои функции и разрушаются. Рассеянный склероз не имеет никакого отношения к бытовому понятию «склероз», или «старческий маразм». Он называется так потому, что склеротические бляшки — участки рубцовой ткани — рассеяны по мозгу. Наиболее частой формой рассеянного склероза является ремиттирующий рецидивирующий РС, при котором периоды рецидивов сменяются периодами ремиссии. Для этой формы в последние годы разработаны препараты, которые уменьшают количество поражений в мозге и снижают частоту рецидивов. Две другие формы — первичный прогрессирующий и вторичный прогрессирующий РС, характеризуются гораздо более агрессивным течением и практически не поддаются терапии (есть ещё и четвёртая форма, прогрессирующе-рецидивирующая, наиболее редкая).
В прошлом году мы рассказывали об успехе в лечении первично-прогрессирующего РС, а в этом году опубликовано сообщение об успехе исследования нового препарата siponimod (Novartis) для лечения вторично-прогрессирующей формы. Это, самое крупное, рандомизированное контролируемое исследование данной формы РС проведено на 1651 пациенте, и новый препарат показал достоверные улучшения по сравнению с плацебо: риск трёхмесячной инвалидизации был на 21% ниже в группе препарата.
Лекарство представляет собой модулятор сфингозин-фосфатных рецепторов на лимфоцитах. Связывание siponimod удерживает лимфоциты в лимфоидных тканях и тем самым препятствует их миграции в мозг, где они способствует развитию заболевания. Препарат с таким механизмом действия, финголимод (также фирмы Novartis), уже используется для лечения ремиттирующего рецидивирующего РС, но он неэффективен при прогрессирующих формах. Видимо, компании удалось создать более селективный препарат.
Открытость клинических данных в США
Ранее мы писали о том, что Европейское медицинское агентство ЕМА обогнало США в плане открытой публикации результатов биомедицинских исследований. В сентябре Национальные институты здоровья США (NIH) опубликовали новые правила, согласно которым информация об идущем клиническом исследовании должна быть доступна на сайте ClinicalTrials.gov не позднее 21 дня после записи первого пациента, а результаты исследований — не позднее года по окончании (для новых лекарств срок может быть продлён до трёх лет). Кроме того, учёные должны отчитаться, как они планируют проводить исследование, раскрыть статистические методы анализа данных и все изменения, внесённые в протокол исследований в ходе эксперимента. Нарушителей агентство FDA имеет право штрафовать на сумму до $10 000 за каждый день задержки, а если исследование ведётся на грант NIH, действие гранта будет прекращено.
Новые правила вступят в силу 18 января 2017 г., и до 18 апреля у организаций, проводящих исследования, есть время подготовиться. Движение в сторону открытости клинических исследований имеет важнейшее значение, так как они представляют собой эксперимент над людьми, который проводится в интересах всех будущих пациентов, и для полноты картины экспертам необходимо знать как положительные, так и отрицательные результаты исследований.
Зарегистрирован сомнительный препарат по миодистрофии Дюшенна
Мы внимательно следим за препаратом компании Sarepta — eteplirsen, который под давлением общественности всё-таки был зарегистрирован FDA вопреки отрицательному заключению панели экспертов. Однако FDA потребовало проведения клинического исследования для подтверждения того, что лекарство улучшает физиологические функции больных, а не только повышает уровень дистрофина в мышцах (белок, генетический недостаток которого и является причиной болезни). Если исследование не покажет физиологических улучшений, лекарство будет отозвано.
В FDA в связи с eteplirsen разгорелся нешуточный скандал: предыдущий глава комиссии по одобрению новых лекарств, который был против одобрения лекарства, и некоторые другие чиновники уволились после заседания комиссии, а большую роль в одобрении лекарства сыграла нынешняя директор комиссии Джанет Вудкок (Janet Woodcock) вопреки открытой критике со стороны как начальства, так и подчинённых. Официальные лица в FDA настоятельно рекомендуют другим компаниям не следовать примеру Sarepta и предоставлять только качественные данные для обоснования регистрации своих продуктов.
В то же время, ускоренное одобрение eteplirsen находится в согласии с новым законом 21st Century Cures Act, подписанным Обамой в декабре. Как мы уже упоминали, одна из особенностей нового закона — упрощение регистрации и вывода на рынок новых препаратов. Как опасаются многочисленные критики, это может привести к снижению стандартов, поднятых FDA за последнее десятилетие на весьма высокий уровень.
Ингибиторы PARP против рака яичника
PARP (поли(АДФ-рибоза)-полимераза) — это фермент, который активируется в клетках в ответ на повреждение ДНК — разрывы в одной из цепей. В клетках рака яичников этот фермент особенно активен и зачастую отвечает за выживание раковых клеток. Идея подавить PARP привела к созданию его ингибитора olaparib и выводу его компанией AstraZeneca на рынок в 2014 году. Однако он одобрен только для пациенток с мутацией BRCA (это та самая мутация, из-за которой Анджелина Джоли приняла решение удалить себе молочные железы и яичники). Дело в том, что он работает лучше у BRCA-мутантных больных, так как BRCA — ещё один белок, отвечающий за репарацию повреждённой ДНК, и когда он не работает, клетка вынуждена пользоваться обходными путями, такими как PARP.
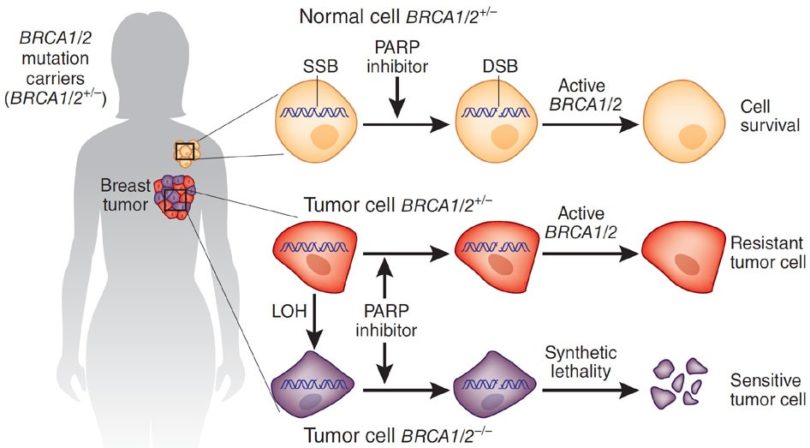
В этом году были опубликованы две новости в области PARP-ингибиторов: результаты исследования фазы 3 препарата niraparib и регистрация rucaparib. Препарат niraparib компании Tesaro показал преимущество по безрецидивному выживанию не только у пациенток с мутацией BRCA, но и без неё. У пациенток с мутацией препарат увеличил медиану времени выживаемости без прогрессирования с 5,5 до 21 месяца по сравнению с плацебо, а у пациенток без мутации — с 3,9 до 9,3 месяцев. Такой результат позволяет niraparib покрыть гораздо большую популяцию пациенток, так как носителями BRCA-мутации являются лишь около 20% больных.
Под конец года FDA зарегистрировало ещё один PARP-ингибитор — rucaparib компании Clovis Oncology для пациенток с мутацией BRCA. Одновременно регистрация выдана на сопровождающий диагностический тест для детекции BRCA-мутации. Тест основан на принципе секвенирования следующего поколения (NGS, next-generation sequencing) и создан одним из лидеров в этой области — Foundation Medicine. Препарат зарегистрирован по ускоренному пути, это означает, что для полноценной регистрации Clovis должна будет предоставить данные клинических исследований, доказывающих пользу препарата в плане продления выживаемости пациентов.
Регистрация нескольких новых лекарств в каждой области лечения рака имеет большое значение для пациентов и врачей, так как позволяет после прогрессирования перейти к следующей опции терапии. В случае рака яичников это особенно актуально, так как многие пациентки годами перебирают линии терапии одну за другой. Однако в области PARP-ингибиторов опыта пока мало и остаётся много неясных вопросов: с какими таргетными препаратами и средствами химиотерапии имеет смысл сочетать PARP-ингибиторы, почему они вообще работают у пациенток без BRCA-мутации, у каких пациенток лучше начинать терапию новыми средствами — у вновь диагностированных или уже пролеченных другими средствами, имеет ли смысл повторять терапию этим или другим препаратом после прогрессии на PARP-ингибиторе и другие. Некоторые из идущих сейчас исследований, возможно, помогут ответить на эти вопросы.
Первое за 40 лет лекарство против саркомы мягких тканей
Саркомы мягких тканей — это группа онкологических заболеваний, поражающих мягкие соединительные ткани, такие как мышцы, сухожилия, связки и пр., в отличие от остеосарком, поражающих кости. Они представляют собой одни из самых смертельных онкологических болезней. Единственным лекарством против этой группы заболеваний был зарегистрированный 40 лет назад химиотерапевтический препарат доксорубицин, который обладает массой побочных эффектов и, как правило, не способен обеспечить длительное выживание, так как в итоге у пациента всё равно происходит рецидив. В этом году FDA впервые зарегистрировало биологический препарат — антитело olaratumab (Eli Lilly) для применения в сочетании с доксорубицином у пациентов, которым не помогла хирургия и радиотерапия.
Olaratumab блокирует рецептор PDGFRα, который экспрессируется на поверхности раковых клеток и стимулирует их рост. Это первый биологический препарат с таким механизмом действия, вышедший на рынок.
В исследовании на 133 пациентах с 25 различными типами метастатических сарком olaratumab в сочетании с доксорубицином показал медианную выживаемость 26,5 месяца по сравнению с 14,7 месяцев в группе доксорубицина. Такой успех в лечении очень устойчивой к терапии опухоли практически без лекарственных опций встречается нечасто, и мы надеемся, что это только начало.
Успехи антисмысловых препаратов
До этого года все препараты класса РНК-антисмысловых олигонуклеотидов проваливались в клинических исследованиях (исключение составляет весьма сомнительный eteplirsen, см. выше). Антисмысловые препараты (антисенсы) представляют собой цепочку РНК, комплементарную матричной РНК (мРНК), которая связывается с мРНК и модулирует экспрессию белка, кодируемого этой мРНК. Если этот белок отвечает за развитие какого-то заболевания, достигается терапевтический эффект. Концепция выглядит очень просто, гораздо изящнее, чем попытки заблокировать действие уже синтезированного белка с помощью малых молекул или других белков. Однако до сих пор антисенсы наталкивались на ряд трудностей, которые препятствовали их успешному применению на практике, а те, что доходили до клинических исследований, проваливались либо из-за отсутствия эффективности, либо из-за неприемлемой токсичности.

В этом году компания Ionis Pharmaceuticals продемонстрировала успехи сразу по двум направлениям: опубликованы положительные результаты исследований третьей фазы по спинальной мышечной атрофии и по гипертриглицеридемии.
Спинальная мышечная атрофия — редкое генетическое заболевание, при котором из-за дефекта белка SMN гибнут моторные нейроны, которые проводят сигнал от спинного мозга к мышцам. Как следствие, постепенно атрофируются сами денервированные мышцы. До настоящего времени лекарства от этой болезни не было, и большинство пациентов умирают, не дожив до 20 лет. Препарат nusinersen (см. также http://22century.ru/medicine-and-health/39256) частично восстанавливает экспрессию белка SMN, а в клинических исследованиях фазы 3, как у пациентов с ранним, так и с поздним наступлением атрофии, он показал статистически значимое превосходство над плацебо по шкале моторных нарушений.
Наследственная гипертриглицеридемия — редкое заболевание, при котором в результате генетического дефекта в крови повышается концентрация триглицеридов и липопротеинов очень низкой плотности (VLDL). Это приводит к повышенному риску развития острого панкреатита и коронарной болезни сердца. Препарат volanesorsen ингибирует синтез белка apo-C-III, который синтезируется в печени и является одним из ключевых регуляторов уровня триглицеридов крови. В исследовании фазы 3 препарат показал снижение триглицеридов на 71,2% по сравнению с 0,9% в группе плацебо, причём эффект сохранялся в течение полугода.
Несмотря на эти успехи, нет гарантии, что препараты будут зарегистрированы и войдут в медицинскую практику. Опубликованы пока первые результаты, доступные пока только в виде пресс-релизов. У агентства FDA и экспертного сообщества имеются основания опасаться высокой токсичности антисенсов, и полные отчёты об исследовании станут предметом скрупулёзного анализа.
Потрясения в исследованиях CAR-T
T-клетки с химерным антигенным рецептором (CAR-T), о которых мы неоднократно писали, — многообещающее средство иммунотерапии рака. Однако эта технология находится в самом начале своего развития, и поэтому неизбежны трагические неожиданности, связанные с её применением. В июле 2016 года исследование компании Juno Therapeutics на пациентах с лейкемией уже было остановлено из-за гибели двух пациентов. Компания изменила протокол исследования, убрав из схемы подготовки пациентов флударабин, предположительно, приводивший к отёку мозга. FDA разрешило продолжить исследование почти сразу, через 3 дня после остановки. Однако, похоже, подобная поспешность была преждевременной — в ноябре программа была остановлена из-за смерти ещё трёх пациентов по той же причине — отёк мозга. Судя по всему, отёк вызван самими клетками, так как его тяжесть коррелировала с их количеством, однако точный механизм учёные пока не установили.
Очень похожие CAR-T той же специфичности (против белка CD19 на поверхности клеток лейкемии и лимфомы) разрабатываются компаниями Kite и Novartis, однако у них подобных проблем пока не выявлено. Наоборот, обе компании доложили о полной ремиссии более чем у 80% тяжёлых пациентов и собираются подавать заявку на регистрацию в 2017 году. У этих продуктов также достаточно тяжёлые побочные эффекты, однако компании надеются, что польза в данном случае превышает риск.
Компании Juno придётся сосредоточиться на других CAR-T продуктах. Ещё один игрок в этой области, компания bluebird bio, опубликовала первые положительные результаты CAR-T с другой специфичностью — анти-BCMA — у нескольких пациентов с очень тяжёлой множественной миеломой, ранее пролеченных в среднем семью другими терапевтическими агентами. У одного пациента наблюдался полный ответ, у остальных — частичный ответ или стабилизация.
Новости генной терапии гемофилии
Компания BioMarin сообщила об успехах в лечении гемофилии А. Её продукт, вирусный вектор (средство доставки гена в клетку), содержащий ген фактора VIII, был введён однократно 9 пациентам. Из семи человек, получивших самую высокую дозу препарата, у шести наблюдалось повышение фактора свёртываемости крови VIII (белка, недостаток которого и приводит к гемофилии A, при которой основная проблема — внутренние и внешние кровотечения) до 50 и более процентов от нормы. Средняя частота кровотечений сократилась с 20 до 5 в год.
Компании Spark Therapeutics и uniQure Biopharma B.V. представили данные для похожих продуктов, но в области гемофилии В. Исследование Spark на 9 пациентах показало восстановление уровня фактора IX до 12—65% от нормального, у uniQure успехи пока скромнее — 3—12% от нормы на 5 пациентах. Правда, и средний срок наблюдения у uniQure пока меньше. С другой стороны, продукт uniQure достаточно хорошо снижал количество кровотечений: с 8,3 до 3,4 в год.
Таким образом, получены убедительные доказательства возможности восстановления свёртываемости крови при гемофилии за счёт генной терапии. Однако основной вопрос пока остаётся открытым — сможет ли генная терапия обеспечить долговременную экспрессию целевых генов в организме человека? Это особенно важно, учитывая огромную стоимость такой терапии, которая может достигнуть $1 млн за дозу. Второй очень важный момент — безопасность. Хотя пока применение современных векторных конструкций не вызывало серьёзных побочных эффектов, ещё свежа в памяти история середины 2000-х годов, когда у 5 детей из 21 генная терапия лимфомы привела к возникновению вторичного онкологического заболевания. Дело в том, что ген, который встраивается с помощью вирусного вектора, может попасть в области ДНК, отвечающие, например, за контроль деления и выживания клеток, что приведёт к их онкологической трансформации.
Успехи и неудачи ингибиторов чекпойнта
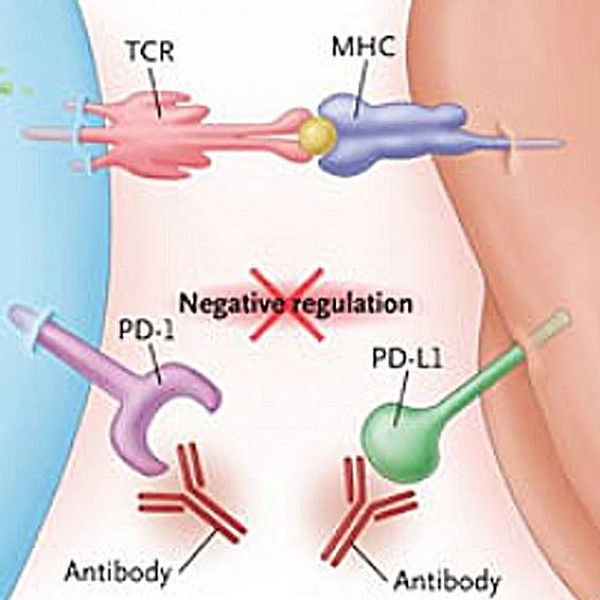
Препараты, которые произвели революцию в лечении некоторых метастатических заболеваний — ингибиторы иммунного чекпойнта — продолжают своё победоносное шествие по областям терапии, но не без некоторых проблем. Речь идёт, в первую очередь, о препаратах Yervoy (ipilimumab, BMS, антитело против CTLA-4), Opdivo (nivolumab, BMS, антитело против PD-1) и Keytruda (pembrolizumab, Merck&Co, антитело против PD-1). Напомним, что эти препараты, вышедшие на рынок в 2011—2015 годах по показаниям метастатическая меланома и рак лёгкого, снимают блок с иммунной системы, давая ей возможность атаковать опухоль. С препаратами этого класса сейчас проводится более 800 исследований: это и всевозможные комбинации, и новые показания, и различные линии терапии.
В 2016 году список конкурентов и показаний в очередной раз расширился. По показанию рак мочевого пузыря FDA был одобрен препарат Tecentriq (atezolizumab, Genentech/Roche). Это первое зарегистрированное антитело против PD-L1 — лиганда белка PD-1, который экспрессируется не на клетках иммунной системы, пришедших в опухоль, а на самих опухолевых клетках. Tecentriq был также одобрен и на второй линии рака лёгкого.
Оба ингибитора PD-1 — Opdivo и Keytruda — расширили список одобренных показаний, теперь они также разрешены к применению у пациентов с раком головы и шеи, устойчивым к препаратам платины.
Opdivo первым из ингибиторов чекпойнта вышел в область гематоонкологии: он показал высокую эффективность в терапии лимфомы Ходжкина, уровень ответов на терапию составил 65%. Препарат был ускоренно одобрен по этому показанию и получит постоянную регистрацию в случае успешного прохождения рандомизированного исследования фазы 3.
Однако в соперничестве между Merck & Co и BMS в области терапии рака лёгкого препарат Opdivo пока потерпел поражение. Если Keytruda успешно вышла в первую линию метастатического рака лёгкого, показав снижение риска смертности на 40%, то Opdivo провалил исследование, не достигнув первичного критерия эффективности — превосходства по выживаемости без прогрессирования по сравнению со стандартной терапией. Важным отличием исследования Keytruda было включение пациентов только с высокой экспрессией PD-L1 в опухоли, более 50%, тогда как в исследование Opdivo включали пациентов с уровнем экспрессии более 5%. Иными словами, BMS попытался охватить более широкую популяцию пациентов и жестоко поплатился за это — стоимость компании сразу упала на $20 млрд.
Огромное количество исследований и десяток новых препаратов, которые выйдут на рынок в перспективе ближайших лет, безусловно, сильно изменят практику лечения рака. Уже сейчас 20—30% пациентов с метастатическими заболеваниями достигают полной ремиссии, тогда как раньше им оставалось жить в среднем год. Однако вопросов ещё очень много, и главный — как охватить оставшиеся 70—80% пациентов? Что поможет им — новые средства? Комбинации уже имеющихся? Ответ на это дадут только будущие исследования.
Другой важный вопрос — цены на новую терапию. Сейчас год лечения одним препаратом стоит 120—150 тысяч долларов. Стоимость комбинации может доходить до 300 тысяч. Очевидно, большинству нуждающихся пациентов и бюджету большинства стран современное лечение не по карману. Однако выход новых средств на рынок обострит ценовую конкуренцию и приведёт к снижению стоимости терапии.
Конец Theranos
Практически завершился скандал с Theranos, о котором мы рассказывали год назад. Напомним, это компания, созданная Элизабет Холмс, молодой харизматичной женщиной, которую журналисты окрестили «Стивом Джобсом в юбке» за пристрастие к чёрным водолазкам и яркие пресс-конференции. В 2003 году она бросила Стэнфордский университет, так как загорелась идеей создать стартап с целью разработки диагностической технологии, которая позволила бы по одной капле крови детектировать сразу десятки заболеваний. Такая постановка задачи сразу способна вызывать скептицизм у любого специалиста в области диагностики, и нужны очень серьёзные доказательства для обоснования такой разработки. Однако Холмс удалось убедить (неспециализированных) инвесторов вложить в проект более $400 млн. Затем, в ходе упомянутых выступлений, девушка много раз утверждала, что технология уже создана и работает. В 2014 году Forbes оценил компанию в $9 млрд и стал называть Холмс самой молодой миллиардершей в мире (ей было 30 лет).
Все начало разваливаться осенью 2015 года, когда после журналистского расследования The Wall Street Journal, которое выявило, что тесты делаются не в Theranos, а отправляются на аутсорс в компанию Walgreens, крови берётся отнюдь не капля из пальца, а обычное количество из вены, и стоимость теста ничем не отличается от средней, в компанию нагрянули проверяющие органы. Были обнаружены нарушения в технологическом процессе и деятельность лаборатории приостановлена. Холмс неоднократно выступала с заявлениями о том, что эти трудности временные, «настоящим инноваторам всегда приходится непросто» и что скоро компания представит все доказательства своей честности. Однако затем выяснилось, что никакой революционной технологии вообще не существует, а результаты тестов, предоставленные пациентам, были некачественными, что ставило под угрозу их здоровье. Элизабет было запрещено руководить лабораториями в течение двух лет.
В ноябре компания Walgreens подала иск на сумму $140 млн, утверждая, что Theranos ввела их в заблуждение относительно достоинств технологии. Также на Theranos подал в суд один из инвесторов, Partner Fund Management, вложивший в 2014 году почти $100 млн. В довершение всего выяснилось, что расследование было начато после того, как внук одного из членов совета директоров (в который входят пожилые ветераны силовых ведомств и политики, например Генри Киссинджер) поработал в компании и понял, что дело неладно. Он обратился сначала к руководству компании, но, не найдя у них понимания, решил привлечь внимание прессы.
Из этой истории можно извлечь несколько поучительных моментов. Во-первых, рано делать какие-то выводы относительно перспективности технологии, если неизвестны детали того, как она работает. Во-вторых, отсутствие специализированных инвесторов и членов совета директоров в компании — плохой признак, так как это означает, что независимая компетентная оценка не проводилась. В-третьих, сколько ни скрывай отсутствие реальных достижений, в этой области в конце концов истина вскроется, и наказание будет тем сильнее, чем наглее была ложь.
***
В этом обзоре не упомянуты важные новости про технологию CRISPR/Cas9, потому что мы неоднократно писали о них ранее, и новость о провале в фазе 3 антительного препарата против болезни Альцгеймера, которая также уже подробно освещалась.
Автор — Илья Ясный.
Источник https://readweb.org/



