Фильм «Тянись и не ленись!» создан видеостудией ГАООРДИ в рамках премии STRIVE от компании PTC Therapeutics.…
Метка: PTC Therapeutics
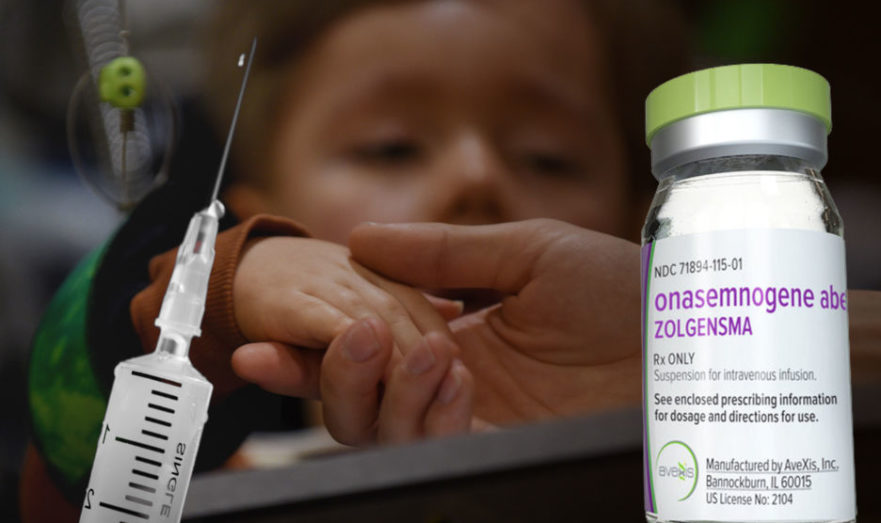
«Круг добра» закупит незарегистрированные препараты для терапии двух редких заболеваний
Экспертный совет фонда «Круг добра» предложил закупить для терапии миодистрофии Дюшенна (МДД) не зарегистрированные в России…
Продолжить чтение
Голикова рассказала о прототипе технологии лечения миодистрофии Дюшенна
Вице-премьер РФ Татьяна Голикова отчиталась о реализации Федеральной научно-технической программы развития генетических технологий, заявив, что Центр…
Продолжить чтение
Миодистрофия Дюшенна: лучший российский и мировой опыт для российских врачей и пациентского сообщества
На первой всероссийской врачебно-пациентской конференции по миодистрофии Дюшенна, что состоялась 11 декабря, участники обсудили диагностику, реабилитацию,…

Риздиплам – разрабатываемое лечение для Спинальной мышечной атрофии (тип 2,3). Положительные результаты
Положительные результаты исследований препарата Риздиплам для Спинальной мышечной атрофии (СМА) 2 и 3 типов 10 ноября…
Продолжить чтение
Risdiplam демонстрируют постоянную пользу для пациентов со спинальной мышечной атрофией
2 октября были представлены новые данные, демонстрирующие постоянную пользу рисдиплама (RG7916) для лечения всех типов спинальной мышечной…
Продолжить чтение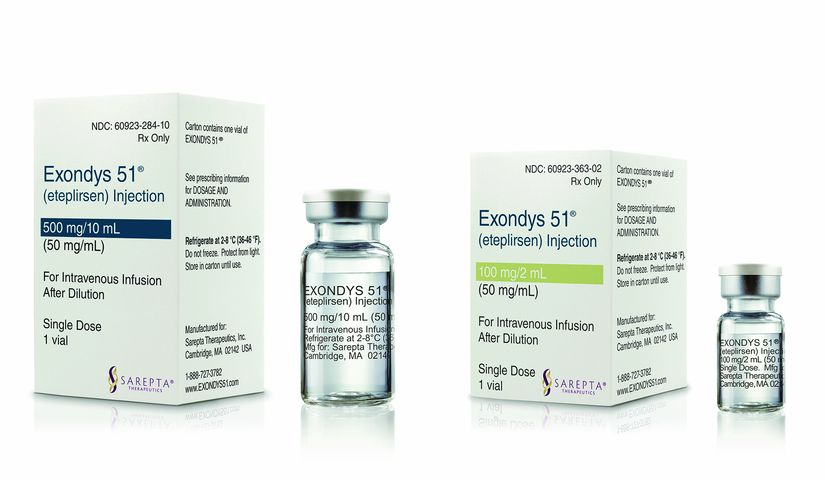
Exondys 51 от Sarepta Therapeutics назвали «дорогим и неубедительно эффективным»
Средство генной терапии мышечной дистрофии Дюшенна Exondys 51 от Sarepta Therapeutics, получившее условное одобрение в 2106…
Продолжить чтение
ЕМА предоставило статус PRIME препарату Рисдиплам компании «Рош» для лечения спинальной мышечной атрофии (СМА)
Рисдиплам может стать первым пероральным препаратом для лечения СМА 1, 2 и 3 типа – редкого…
Продолжить чтение
Новые данные о планах по регистрации досье на препарат Рисдиплам для лечения СМА
7 января компания PTC Therapeutics, Inc в рамках презентации на 37-й ежегодной конференции JP Morgan Healthcare…
Продолжить чтение
Подходы к лечению мышечной дистрофии Дюшенна, которые обсуждались на конференции PPMD
Дискуссия о работе над четырьмя различными подходами к лечению мышечной дистрофии Дюшенна (DMD) — восстановлению или…
Продолжить чтение
Повторный анализ клинических испытаний показывает потенциал Емфлазы для сохранения двигательной функции у мальчиков с МДД
Лечение Емфлазой (дефлазокортом) лучше для сохранения двигательной функции у пациентов с мышечной дистрофией Дюшенна (МДД), чем…

Обновленный статус исследовательских программ в области СМА компании Roche
В настоящий момент компания Roche ведет клинические разработки 2 молекул для терапии спинальной мышечной атрофии (СМА)…
Продолжить чтение
Клинические исследования препарата Translana на территории Российской Федерации
Компания РТС инициировала клинические исследования препарата Translana, разработанного для коррекции нонсенс мутации в гене Дистрофин, на…

PTC Therapeutics не удалось убедить FDA в эффективности препарата для лечения МДД
Американская фармацевтическая компания PTC Therapeutics не смогла убедить FDA в эффективности своего препарата Translarna (ataluren) для…
Продолжить чтение
Два мальчика против государства: суд не на жизнь, а на смерть
Заболевание обрекает их на смерть в возрасте примерно 20 лет. Лекарство, способное продлить жизнь, уже применяется…
Продолжить чтение
Регионы судятся с больными детьми
Пациентам с редкими заболеваниями отказывают в дорогостоящих лекарствах. Право на лечение редких болезней пациентам всё еще приходится…
Продолжить чтение
Компания Roche сообщила последние данные по проводимым исследовательским программам
Компания Roche представила последнюю информацию о 2 пероральных препаратах, находящихся на стадии разработки, Олезоксиме и RG7916.…
Продолжить чтение
Аталурен не прошел клинические исследования для лечения муковисцидоза
Американская фармацевтическая компания PTC Therapeutics Inc прекратила разработку препарата ataluren для лечения муковисцидоза, поскольку препарат не…


