Компания Avidity Biosciences сообщила, что её препарат дель-зота (для пациентов с делециями, корректируемыми пропуском экзона 44) получил от FDA статус прорывной терапии, об этом 23.07.2025 г. сообщил родительский проект (США).
Препарат дель-зота в настоящее время проходит испытания в рамках второго этапа открытого расширенного клинического исследования EXPLORE44 (EXPLORE44-OLE™) и является первым из разрабатываемых компанией методов лечения МДД путем пропуска экзонов. Этот метод предполагает доставку фосфородиамидатных морфолиноолигомеров (PMO) в скелетные мышцы и сердечную ткань для специфического пропуска 44 экзона гена дистрофина и обеспечения выработки практически полноразмерного дистрофина.
По данным компании Avidity, в завершённом исследовании фазы 1/2 EXPLORE44® препарат дель-зота продемонстрировал статистически значимое увеличение пропуска экзонов, существенное увеличение продукции дистрофина, значительное и устойчивое снижение уровня креатинкиназы до практически нормального, а также стабильно благоприятные показатели безопасности и переносимости. Компания планирует представить основные и функциональные данные текущего исследования фазы 2 EXPLORE44-OLE в четвёртом квартале 2025 года и планирует подать заявку на получение лицензии на биологический препарат (BLA) в конце 2025 года.
Статус «прорывной терапии» (Brewthrough Therapy) используется FDA для ускорения разработки и оценки методов лечения серьёзных заболеваний, таких как миодистрофия Дюшенна. Он присваивается, когда ранние клинические данные свидетельствуют о том, что терапия может обеспечить значительное улучшение по сравнению с существующими вариантами по ключевым показателям эффективности. Помимо статуса «прорывной терапии», препарат дель-зота ранее был признан орфанным препаратом, а также препаратом, имеющим статус лекарства для «редкого детского заболевания» (Rare Pediatric Disease) и статус «Ускоренного рассмотрения» (FDA) для лечения пациентов с миодистрофией Дюшенна, мутации которых корректируются пропуском экзона 44.
PPMD рад тому, что дель-зота получила статус «прорывной терапии» и воодушевлен успехами программы Avidity по экзону 44. Родительский проект с оптимизмом смотрит на новости и с нетерпением ждет информации от Avidity в ближайшие месяцы.
23 июля 2025 г.
Письмо сообществу от компании Avidity Biosciences:Уважаемые партнеры по защите интересов пациентов с МДД,Мы рады сообщить, что FDA предоставило препарату делпасибарт зотадирсен (сокращенно дель-зота) статус принципиально нового лекарственного средства для лечения пациентов с мышечной дистрофией Дюшенна, мутации которых корректируются пропуском экзона 44 (DMD44).
Мы понимаем, что за последнюю неделю сообщество пациентов с МДД получали разноплановые важные новости, и мы разделяем ваше чувство безотлагательности и наше желание как можно скорее предоставить сообществу пациентов с МДД необходимые методы лечения.
Ожидаемые сроки разработки и потенциального одобрения дель-зота остаются неизменными, и мы по-прежнему следуем графику подачи запланированной заявки на получение лицензии на биологический препарат (BLA) в конце 2025 года.Статус «прорывной терапии» присваивается FDA для ускорения разработки и рассмотрения препаратов для лечения серьёзных или угрожающих жизни состояний. Для получения статуса «прорывной терапии» необходимо наличие предварительных клинических доказательств, демонстрирующих, что препарат может обеспечить существенное улучшение как минимум по одной клинически значимой конечной точке по сравнению с существующими методами лечения.
Мы хотим поблагодарить всё сообщество МДД за ваше время, преданность делу и постоянный вклад в разработку препарата «дель-зота». В частности, мы выражаем огромную благодарность участникам исследований EXPLORE44® и EXPLORE44-OLETM, их семьям, исследователям и их командам. Ваше участие в программе EXPLORE44 позволило получить данные, подтверждающие это назначение, а также данные, необходимые для перехода препарата «дель-зота» на следующий этап разработки.Это присвоение статуса FDA дополнительно подтверждает значительный потенциал препарата «дель-зота» для лечения основной причины миодистрофии Дюшенна (МДД)44 и подчеркивает неудовлетворенную потребность в нем пациентов с МДД. В настоящее время «дель-зота» является экспериментальным препаратом. Он не был одобрен FDA или каким-либо другим регулирующим органом для коммерческого использования, а безопасность и эффективность препарата «дель-зота» не установлены.
Мы рекомендуем вам обратиться к врачу, если у вас возникнут какие-либо вопросы о препарате del-zota или исследованиях EXPLORE44 и EXPLORE44-OLE.
Искренне,
Команда Avidity
Комментарий от БФ «Гордей»
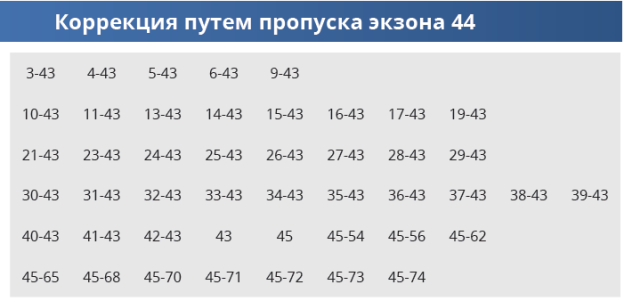
Гремякова Т.А. Начальник детского высокотехнологичного нейро-мышечного центра ЦКБ УДП РФ, президент БФ «Гордей»Позитивные новости для семей, в которых растут мальчики с мутациями типа делеций, которые корректируются пропуском экзона 44, таких пациентов статистически ≈ 4% от популяции. В регистре БФ «Гордей» 1300 пациентов, то есть препарат подойдет ориентировочно 50 пациентам, учитывая статус амбулаторности – 30.Перечень возможных мутаций представлен в Таблице:
Терапия в дозе 5 мг/кг вводится внутривенно раз в 6 недель. Для воздействия на экзон 44 гена DMD использует моноклональное антитело, конъюгированное с фосфородиамидатными морфолиноолигомерами (PMO). Терапия показала статистически значимое увеличение степени пропуска экзона и продукции дистрофина, а также снижение уровня креатинкиназы.
Основные результаты исследования EXPLORE44:
— Пропуск экзона: препарат дель-зота продемонстрировал статистически значимое увеличение пропуска экзона 44 на 37%.
— Выработка дистрофина: терапия привела к статистически значимому увеличению уровня дистрофина на 25%.
— Уровень креатинкиназы: приём дель-зота снижал уровень креатинкиназы практически до нормы, более чем на 80% по сравнению с исходным уровнем.
— Доставка: терапия продемонстрировала эффективную доставку PMO в скелетную мышечную ткань.
— Сроки: положительная динамика отмечалась уже псле первой инфузии примерно через 4 недели.
— Безопасность: дель-зота продемонстрировал благоприятные показатели безопасности и переносимости в обеих исследованных дозах.Ждем решений международных регуляторных органов в 2026 г.
Источник dmd-russia.ru