Боковой амиотрофический склероз – тяжелейшее нейродегенеративное заболевание. Причины его остаются неизвестными, и новое исследование американских ученых представляет собой важный шаг вперед в понимании и, в конечном итоге, в лечении БАС.
Многие, наверняка, помнят недавнюю акцию, в ходе которой известные политические и общественные деятели, артисты и ученые обливали себя ледяной водой. Целью этой акции было привлечь внимание и повысить информированность общества о боковом амиотрофическом склерозе – разрушительном нейродегенеративном заболевании, выражающемся в прогрессирующем ослаблении мышц и нарушении координации движений. Но то, чему средства массовой информации уделяют гораздо меньше внимания, это успехи ученых в понимании причин и разработке методов лечения этого недуга.
Боковой амиотрофический склероз (БАС), или болезнь Лу Герига, известен как трудно поддающееся лечению заболевание. При этом очень мало известно о причинах его развития. Редкое открытие – обнаружение молекулярного дефекта на месте контакта нейронов и мышц – может углубить понимание основных механизмов развития БАС.
У здоровых людей нервные клетки, называемые двигательными нейронами, контактируют с мышечными волокнами в местах, известных как нервно-мышечные синапсы. Правильное функционирование этих структур позволяет нервной системе надлежащим образом осуществлять контроль над движениями и другими важными функциями. У пациентов с БАС происходит массовое отмирание моторных нейронов, что препятствует образованию нервно-мышечных синапсов так таковому.
Изучая БАС, Даниэла Зарнеску (Daniela Zarnescu) и Алисса Койн (Alyssa Coyne), опубликовавшие статью в журнале The Journal of Neuroscience, использовали в качестве модели плодовую мушку Drosophila melanogaster. Подобная модель дает ученым возможность подойти к выяснению причин заболевания на основе молекулярного и генетического подходов и облегчает задачу точно указать, когда и где что-то пошло не так.
«Когда говоришь, что в качестве модели человеческого заболевания ты используешь плодовую мушку, на тебя смотрят с некоторым подозрением», – говорит д-р Зарнеску, доцент кафедры молекулярной и клеточной биология Университета Аризоны (University of Arizona). «Но использование упрощенных моделей может помочь раскрыть то, что очень важно в контексте этой болезни».
Зарнеску и Койн, аспирант в области нейронаук, решили изучить белок TDP-43, который и раньше связывался с БАС. Они установили, что TDP-43 регулирует синтез и транспорт другой молекулы – белка Futsch – к нервно-мышечному синапсу. В модели БАС, воспроизведенной на дрозофилах, TDP-43 препятствует транспорту Futsch в нервно-мышечное соединение, что приводит к нарушению связи.
«Алисса открыла, что именно эта молекула не регулируется должным образом. Она не синтезируется в нужном месте или в нужном количестве», – объясняет д-р Зарнеску. «Вместо того чтобы доставляться в нервно-мышечный синапс, она остается в теле клетки и не может поддерживать стабильность соединения».
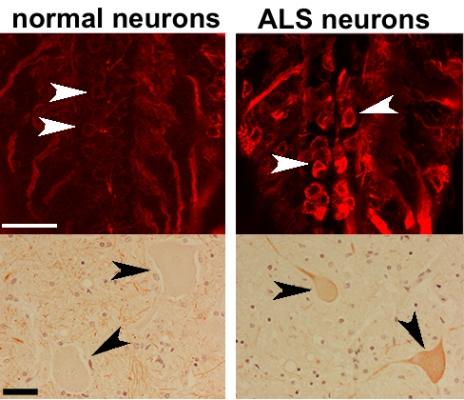
в телах моторных нервных клеток. По сравнению со здоровыми нейронами (слева) в нейронах при БАС отчетливо видны
скопления этих белков. (Фото: Daniela Zarnescu)
Исследователи решили выяснить, поможет ли увеличение количества Futsch восстановить функцию неисправного синапса. Поразительно, но гиперэкспрессия Futsch в двигательных нейронах привела к повышению стабильности соединения, увеличению продолжительности жизни нейронов и восстановлению двигательной функции у плодовых мушек с моделью БАС.
Здесь самое время задаться вопросом: есть ли что-либо общее между БАС в нервной системе дрозофилы и БАС у человека?
Чтобы выяснить это, Зарнеску и Койн организовали сотрудничество с учеными из Неврологического института Бэрроу (Barrow Neurological Institute) в Фениксе. Они хотели изучить клетки спинного мозга пациентов с БАС, а в них белок MAP1B – аналог белка Futsch у млекопитающих. Как оказалось, нарушение локализации MAP1B было очень похоже на таковое белка Futsch в нейронах плодовых мушек. Это сходство предполагает сопоставимые дефекты в человеческой и мушиной моделях БАС.
«Это подчеркивает важность изучения болезней человека на простых моделях», – комментирует д-р Зарнеску. «Это очень мощные модели, способные предсказать дефекты, присутствующие у больных людей».
По мнению исследователей, полученные ими результаты представляют собой важный шаг вперед в понимании и, в конечном итоге, в лечении БАС.
«Это исследование является одним из первых, в которых продемонстрирован такой яркий молекулярный дефект в синаптических связях при БАС», – подводит итог Зарнеску. «Мы пока еще не знаем точно, что происходит при БАС, но это открытие дает возможное объяснение».
Оригинальная статья
- Источник(и): http://www.nanonewsnet.ru/



