Ученые из США выявили новое соединение, которое может продлить жизнь пациентов с боковым амиотрофическим склерозом. Этим заболеванием болен физик Стивен Хокинг, и несмотря на то, что оно убивает в течение нескольких лет, ученый прожил с ним больше полувека. «Лента.ру» рассказывает, как Хокингу удалось обмануть смерть и что делают исследователи для борьбы с неизлечимой болезнью.
Боковой амиотрофический склероз (БАС), или мотонейронная болезнь, также известная в США как болезнь Лу Герига, — редкое заболевание центральной нервной системы, приводящее к параличам конечностей и атрофии мышц. Оно стало широко известно в 1939 году, когда установивший несколько рекордов американский бейсболист Генри Луи Гериг ушел из спорта в возрасте 36 лет. Оказалось, что он страдал от быстро прогрессировавших неизлечимых нарушений двигательных функций. Спортсмен скончался через два года после постановки диагноза.
Большинство пациентов живут не дольше пяти лет после того, как болезнь обнаружена. Физику-теоретику Стивену Хокингу был двадцать один год, когда ему диагностировали БАС, однако он дожил до 75-летнего возраста, хотя и был на грани смерти в 1985 году из-за воспаления легких.
Каждая мышца управляется мотонейронами, расположенными в двигательной коре в задней части лобной доли мозга или в мозговом стволе. Они передают сигналы мотонейронам, которые находятся в спинном мозге. Первые называют верхними мотонейронами, а вторые — нижними. В ряде стран выделяют различные формы мотонейронных заболеваний, затрагивающий одну или обе группы нервных клеток. Например, первичный боковой склероз (ПБС) поражает верхние моторные нейроны, прогрессирующая мышечная атрофия (ПМА) — нижние, а при БАС нарушаются функции всех мотонейронов. Тем не менее, по словам специалистов, вскрытие умерших пациентов показывало, что при ПБС и ПМА наблюдаются также патологические изменения в нижних и верхних нейронах соответственно.
Лео Маккласки (Leo McCluskey), профессор неврологии Пенсильванского университета, в своем интервью изданию Scientific American назвал заблуждением представление о том, что БАС затрагивает только моторные нейроны. Примерно у 10 процентов пациентов с мотонейронными заболеваниями наблюдались нарушения функций в других частях мозга, например, в лобных и височных долях, где не содержатся мотонейроны. Хотя считается, что болезнь Лу Герига не влияет на умственные способности, у некоторых больных все же отмечалось развитие лобно-височной деменции.

Фото: Public Domain / Wikimedia
Продолжительность жизни пациентов с БАС часто зависит от того, как долго работают нейроны, отвечающие за движение диафрагмы и, соответственно, вентиляцию легких. Когда они отказывают, возникает дыхательная недостаточность, которая является основной причиной смерти. Если нарушается функция глотательных мышц, больные умирают от голода и обезвоживания. Если ничего из этого не происходит, человек может жить многие годы, хотя качество его жизни сильно ухудшается. Так, Стивен Хокинг передвигается только с помощью компьютеризированного инвалидного кресла, снабженного синтезатором речи и инфракрасным датчиком движения. Эти устройства позволяют ему писать статьи и общаться с другими людьми.
Одной из причин того, что болезнь Хокинга не затронула работу диафрагмы и глотательных мышц, может быть ранняя форма БАС. По словам Маккласки, в его практике встречались пациенты, у которых заболевание было диагностировано в подростковом возрасте, и они дожили до 60 лет. Однако точные причины долгожительства нескольких процентов пациентов пока не ясны.
БАС до сих пор неизлечим, хотя выяснение его причин и механизмов являются целью активных исследований. Было выяснено, что, как и в случае многих других нейродегенеративных заболеваний, в клетках головного мозга накапливаются аномальные белки в нейронах центральной нервной системы. 5-10 процентов всех случаев бокового амиотрофического склероза вызваны наследственными факторами, однако заболеванию может способствовать не один, а множество генов. Для того чтобы вылечить БАС или хотя бы замедлить его прогрессирование, необходимо найти соединения, которые регулируют активность этих генов.
Американские ученые из Калифорнийского университета в Риверсайде выяснили, какие молекулы подавляют активность рецепторного белка EphA4, который связывают с быстрым развитием БАС. В своих исследованиях биологи использовали мышиную модель бокового амиотрофического склероза — мыши, которые страдали от заболевания, аналогичного болезни Лу Герига у человека. Статья исследователей опубликована в журнале Cell Biology.
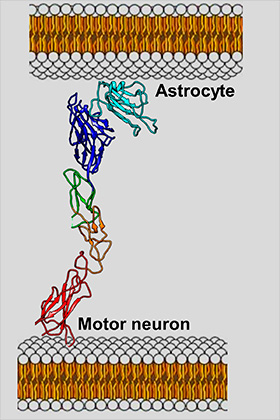
EphA4 опосредует взаимодействие между моторными нейронами и астроцитами, которое, по мнению авторов работы, является одной из причин быстрой гибели первых.
Синтез белка EphA4 связан не только с прогрессирующим нарушением функций мотонейронов, но и с заболеваниями крови, при которых нарушается свертываемость, болезнью Альцгеймера, а также язвами желудка и поджелудочной железы. Однако нельзя точно сказать, каким образом можно подавить активность белка и как это повлияет на состояние пациента, поскольку исследователи не знали, какие соединения могут быть ингибиторами EphA4. Однако было точно известно, что мутации в гене, кодирующем белок, увеличивают продолжительность жизни больных животных.
Чтобы выявить подходящее соединение, ученые проанализировали молекулярное строение более ста тысяч химических веществ, применяя спектроскопию ядерного магнитного резонанса. Они искали молекулу, которая могла бы связаться с EphA4, используя подходы по оценке белок-белковых взаимодействий. Исследователи обнаружили, что таким соединением является 123C4.
Это вещество не подавляет рецептор EphA4, однако вызывает его интернализацию. Иными словами, белок после связывания с 123C4 уходит с поверхности клетки внутрь через процесс, называемый эндоцитозом. По словам ученых, 123C4 эффективно удаляет EphA4 с поверхности моторных нейронов.
Чтобы подтвердить способность препаратов на основе 123C4 продлевать жизнь, необходимо провести клинические исследования. Пока больным ряда стран (в США и Европе) доступен рилузол — единственное одобренное средство, которое продлевает жизнь пациентов на несколько месяцев.
Источник https://lenta.ru/



