При формировании мышц во время эмбрионального развития одним из ключевых событий является слияние миобластов (клеток — предшественников мышечных клеток) в единое многоядерное мышечное волокно — синцитий. И хотя генетические механизмы, управляющие развитием скелетных мышц, хорошо изучены, механизм, координирующий слияние миобластов, оставался не до конца понятными. Было известно множество белков, тем или иным образом имеющих отношение к слиянию миобластов (вовлеченных в адгезию клеток, динамику актина и т. д.), однако ни один специфический для мышечных клеток белок не отвечал именно за слияние клеток в один общий синцитий. Ученые из техасского Юго-западного медицинского университета обнаружили специфический мембранный белок мышечных клеток (его назвали миомейкер), который экспрессируется во время формирования мышц и необходим для слияния миобластов.
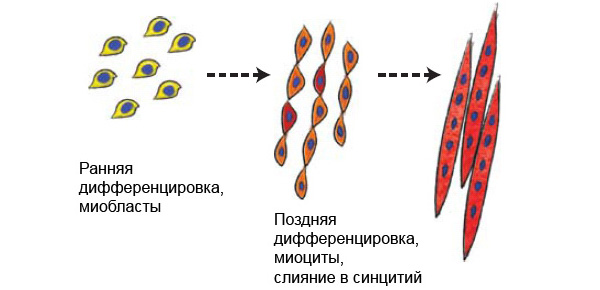
Закладка мышечной ткани и формирование мышц — миогенез (см. myogenesis) — происходит во время внутриутробного развития, причем в несколько стадий, каждая из которых принципиально важна для развития организма, управляется несколькими различными белками и нарушение каждой из которых может привести к недоразвитию каких-либо групп мышц.
Основными стадиями миогенеза являются: деламинация (разделение слоев клеток), миграция клеток, пролиферация (разрастание ткани путем деления клеток) и два этапа специализации клеток — детерминация (выбор клеткой программы развития) и дифференцировка (явно выраженная специализация). Эти стадии происходят на внутриклеточном уровне, это первый этап миогенеза. На втором этапе происходит уже формирование самой мышечной ткани, для чего необходимы стадия слияния клеток в вытянутые многоядерные мышечные клетки — миоциты и образование мышечных волокон, а также стадия образования клеток-сателлитов (то есть клеток, необходимых для регенерации, восстановления и роста мускулатуры уже во взрослом состоянии).
Мышечные волокна, из которых состоят мышцы, представляют собой синцитий — результат слияния нескольких клеток-предшественников (миобластов). Причем процесс слияния этих клеток должен быть высокоспецифичным: чтобы один миобласт сливался с другим таким же миобластом, но не с клеткой другого типа. И хотя белки, управляющие развитием скелетных мышц, хорошо изучены, до последнего времени было непонятно, что координирует слияние миобластов. Было известно, что есть белки, необходимые только на первом этапе миогенеза (например, белки Pax3, c-met), и есть белки, необходимые и на втором этапе (белки MyoD, Myf5, Myogenin). Однако было неясно, какой белок отвечает именно за слияние мембран мышечных клеток в один общий синцитий и образование мышечных волокон.
Чтобы выявить какие-либо гены, задействованные на этом последнем этапе, группа ученых из техасского Юго-западного медицинского университета сравнила экспрессию генов, отвечающих за основные белки поздних стадий миогенеза (например, белок MyoD), и экспрессию других генов из генома мыши, про которые не было известно, участвуют ли они в формировании мышц. Среди генов, экспрессия которых повышалась одновременно с экспрессией миогенных белков, был ген, кодирующий трансмембранный белок с неизвестной функцией. Авторы предположили, что этот белок необходим для поздних стадий миогенеза, и назвали его «миомейкер».
Дальнейшие исследования подтвердили предположение авторов статьи: оказалось, что экспрессия гена, кодирующего белок миомейкер, резко возрастает во время дифференцировки и слияния клеток мышечной клеточной линии C2C12. Чтобы выяснить, как происходит формирование мышц у зародышей мышей, у которых ген, отвечающий за белок миомейкер, выключен («молчит»), авторы использовали следующую схему. Каждый ген имеется в клетке, как правило, в двух вариантах-аллелях, один из которых достаётся от матери, а другой — от отца. Авторы поочередно выключали один или оба аллеля гена, отвечающего за белок миомейкер. Таким образом они создали два варианта мутантных зародышей мышей с выключенным геном белка-миомейкера: гетерозиготные (с одним «молчащим» аллелем) и гомозиготные (с двумя «молчащими» аллелями миомейкера, то есть с полностью выключенным геном и с полным отсутствием соответствующего белка).
Для выключения гена авторы пользовались следующим методом: вставляли внутрь гена, который нужно выключить, другой ген, продукт которого легко обнаружить при окрашивании определенным методом. Если при окрашивании авторы видели продукт встроенного гена, можно было понять, что второй ген встроился удачно, то есть что целевой ген выключен.
Оказалось, что у зародышей мышей, гомозиготных по отсутствию гена миомейкера, нет дифференцированных мышц головы, туловища или конечностей (различия стали заметны уже на 12,5 день внутриутробного развития; см. рис. 2), и это несмотря на то, что другие белки, отвечающие за развитие мышц, например белок MyoD, присутствовали в обычном количестве. Более того, ранние этапы формирования мышц у зародышей были в норме, зародыши имели абсолютно нормальные внутренние органы и продолжали нормально дышать и развиваться до определённого момента.
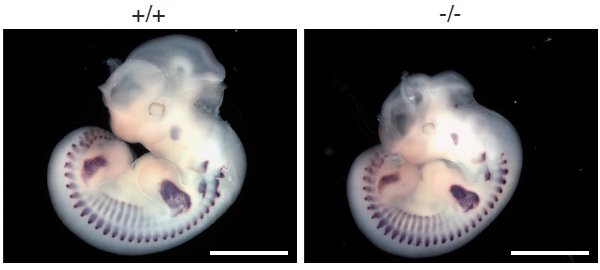
Надо заметить, что различия в развитии скелетной мускулатуры зародыша по сравнению с контролем видны уже на 17,5 день внутриутробного развития (рис. 3). Ученые также сравнивали срезы различных мышечных тканей, на которых явственно видно образование мышечных волокон у нормальных зародышей мышей, в то время как у зародышей мышей, у которых не было белка миомейкер, в тех же самых тканях и на тех же этапах мышечные клетки по-прежнему находились в одиночном, разрыхленном состоянии. Ни один мышонок, не имевший рабочего гена, отвечающего за белок миомейкер, не прожил после рождения и нескольких дней из-за полной неразвитости скелетной мускулатуры.
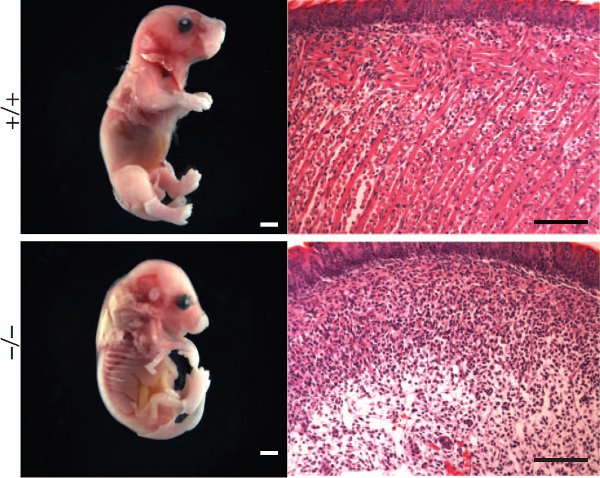
Чтобы подтвердить свои данные, авторы выделили миобласты из зародыша и наблюдали за ними отдельно от всего организма — при этом клетки зародыша дикого типа (контроль с нормальным геном белка миомейкера) через 3 дня дифференцировки начали формировать многоядерные мышечные волокна. Клетки же зародыша, гомозиготного по отсутствию гена миомейкера, так и оставались одиночными миобластами: слияния клеток с образованием мышечных волокон не происходило.
В следующем опыте ученые решили встроить дополнительные копии гена белка миомейкера в мышечную клеточную линию посредством специального ретровирусного вектора, таким образом «размножив» в геноме копии гена белка миомейкера (для контроля в другую линию встроили «пустой» ретровирусный вектор, не содержащий ничего, кроме флюоресцентного белка GFP). На 4-й день после начала опыта среди полученных клеток было заметно больше слившихся многоядерных клеток, чем в контроле (рис. 4). При этом кинетика экспрессии других факторов, необходимых на этапе слияния клеток (миогенин, MyoD и т. д.), в клетках с увеличенным содержанием миомейкера была такая же, как в контрольных клетках. Увеличение копий гена, кодирующего белок миомейкер, приводило не только к слиянию мышечных клеток в волокна, но и к слиянию самих мышечных волокон. То есть при избыточном количестве белка слияние клеток происходило слишком активно, так что даже вызывало слияние на более высоких уровнях.
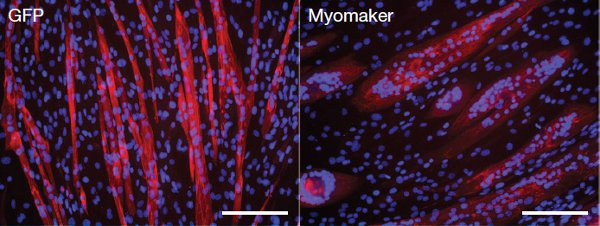
Интересно, что в опытах на других, немышечных, типах клеток (например, фибробластах), клетки с «добавленной» активной копией гена, кодирующего белок миомейкер, способны сливаться с мышечными клетками, что приводит к образованию гибридных, «неправильных» клеток.
Авторы выяснили, что миомейкер — это высококонсервативный белок, состоящий из 221 аминокислоты и имеющийся у всех позвоночных, начиная от рыб и заканчивая человеком. Посредством экспериментов с антителами, а также вестерн-блоттинга было установлено, что белок находится в мембране; это также подтверждается тем, что у него имеются гидрофобные регионы, что характерно для всех мембранных белков.
Таким образом, техасские ученые открыли необходимый для миогенеза белок, без которого невозможно образование мышечных волокон. Этот белок находится в мембранах мышечных клеток и вызывает их «объединение» в одно мышечное волокно. Возможно, это открытие в будущем поможет при лечении различных заболеваний мышц. Например, дополнительное введение этого белка или гена, который его кодирует, можно будет использовать при лечении дистрофий, связанных с нарушением формирования мышц.
Источник: Douglas P. Millay, Jason R. O’Rourke, Lillian B. Sutherland, Svetlana Bezprozvannaya, John M. Shelton, Rhonda Bassel-Duby, Eric N. Olson. Myomaker is a membrane activator of myoblast fusion and muscle formation // Nature. 2013. V. 499. P. 301–305.
См. также:
C. Florian Bentzinger, Yu Xin Wang, Michael A. Rudnicki. Building muscle: molecular regulation of myogenesis // Cold Spring Harbor Perspectives in Biology. 2012. V. 4. P. a008342. Обзор в открытом доступе.
Илья Скляр
Источник: http://elementy.ru/news/432065



