Молекулярные биологи из Университета Калифорнии в Сан Диего (США) на основе технологии CRISPR/Cas9 разработали метод устранения транскрипов «паразитной» РНК. Накопление такой РНК связано с развитием множества тяжелых заболеваний, таких как боковой амиотрофический склероз, миотоническая дистрофия мышц, болезнь Хантигтона и т.д. Ученым удалось испытать новый метод пока только на отдельных клеточных линиях, однако результаты исследований выглядят достаточно перспективно с точки зрения терапии этих до сих пор неизлечимых заболеваний. Статья исследователей опубликована в журнале Cell.
Микросателлиты — это участки генома, представляющие собой множественные повторы коротких (менее 9 букв) нуклеотидных «фраз», вроде (CTG)n, (CCTG)n и т.д.. Они составляют значительную часть всего генома человека и часто рассматриваются в качестве так называемой мусорной, то есть не выполняющей никаких осмысленных функций ДНК. Подобные повторы встречаются как вне, так и внутри генов (прежде всего в некодирующих участках, интронах), они имеют тенденцию быстро изменяться (увеличиваться или уменьшаться) от поколения к поколению, что, например, используется в генетике для установления родства между близкими индивидами.
Экспансию таких последовательностей, если они находятся внутри генов, медики связывают с развитием нескольких тяжелых заболеваний. По-видимому, увеличение числа повторов в ДНК вредно не само по себе, а как причина неправильного созревания (сплайсинга) матричной РНК этих генов. Развитие заболевания обычно сопровождается накоплением в ядре точечных агрегатов РНК c этими «мусорными» последовательностями. Иногда такая РНК даже транслируется в белки, что приводит к накоплению нерастворимых белковых агрегатов и приводит к гибели клеток. На уровне организма это выглядит как необратимая дистрофия мышц, отмирание периферических нейронов и так далее.
Причинно-следственная связь между накоплением микросаттелитов в генах и развитием тех или иных симптомов болезни пока исследована слабо и находится для большинства обсуждаемых болезней на уровне доказанной корреляции. В случае одного из типов бокового амиотрофического склероза подробнее можно почитать здесь, в случае миодистрофиии — здесь и здесь, про болезнь Хантингтона — здесь. Тем не менее, есть основания полагать, что поскольку каждое из заболеваний сопровождается накоплением агрегатов РНК в ядрах, то и устранение этих агрегатов может привести к устранению симптомов заболевания. Именно этим руководствовались авторы новой статьи, разработавшие метод устранения агрегатов и «вылечившие» с его помощью несколько клеточных культур.
Теоретически, устранить причину обсуждаемых заболеваний можно было бы с помощью точечного вмешательства в геном: достаточно удалить повторы, привести нужные гены в «нормальное» состояние и причина болезни будет ликвидирована. Совершенствование технологии CRISPR/Cas9 (о том, что это, можно почитать здесь) сделало эту теоретическую возможность практической опцией терапии. В некоторых случаях такой подход уже даже вышел на стадию клинических исследований.
Проблема в том, что редактирование генома подразумевает разрезание ДНК, а это чревато резким увеличением числа мутаций в клетках. Кроме того, применение даже самых точных «геномых ножниц» неизбежно приводит к возникновению лишних, нецелевых (off-target) разрезов в других местах генома, что также опасно и может сопровождаться развитием злокачественных новообразований. Обсуждение масштаба таких нецелевых разрывов при генетической терапии сейчас находится в самом разгаре, и, возможно, в реальности опасность CRISPR/Cas9 сильно преувеличена. Как бы то ни было, переход от ДНК к РНК позволяет устранить эту проблему полностью: какие бы побочные разрывы не происходили в РНК, они не отразятся на стабильности генома. Далеко не для всех болезней такой переход возможен, однако именно поэтому авторы новой статьи обратили свое внимание на те заболевания, что связаны с накоплением микросаттелитной РНК.
Работает новый метод следующим образом. В клетки с помощью модифицированного аденовируса вносится генетический конструкт, который содержит направляющую РНК и специализированную версию нуклеазы Cas9. Последняя не способна разрезать ДНК, т.к. в ее активном центре искусственно удалены необходимые для этого аминокислоты. Тем не менее, инактивированная нуклеаза может связываться с молекулами РНК под руководством соответствующей направляющей РНК. К модифицированной Cas9, названной авторами RСas9, также присоединена короткая РНКаза, которая уничтожает те РНК, к которым присоединяется комплекс.
В ходе экспериментов на клеточных линиях, в т.ч. и выделенных у пациентах с миодистрофией, ученые показали, что RСas9 действительно способна устранять агрегаты специфической для заболевания микросаттелитной РНК. Кроме того, в клетках происходить нормализация измененного при дистрофии сплайсинга (на уровне всего генома, а не отдельного гена с микросателлитами) и резко падает концентрация количество пептидов, транслированных с микросаттелитных повторов. Что касается побочных эффектов, то авторы оценили воздействие системы на нецелевые РНК как незначительное: по данным транскриптомного анализа, менее 10 различных генов изменили свой уровень экспрессии в результате применения RСas9. Отдельная часть статьи посвящена экспериментам по уменьшению размера Cas9 таким образом, чтобы получившийся конструкт можно было поместить в очень ограниченный геном вируса-носителя.
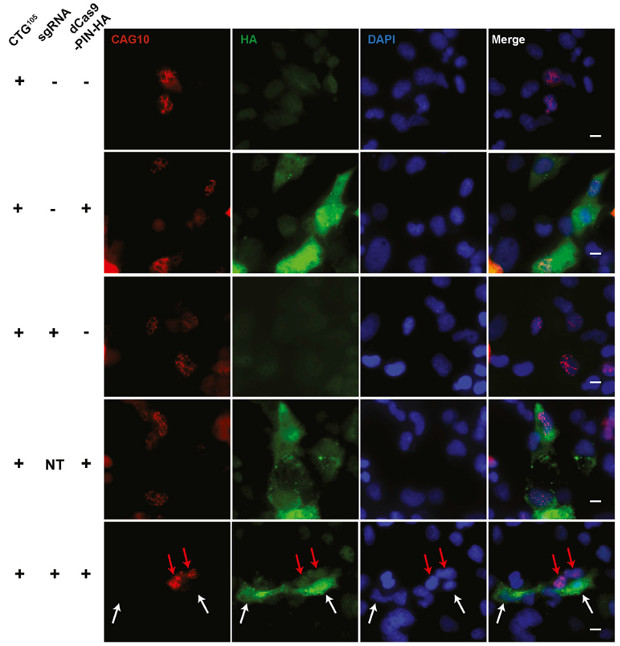
Ranjan Batra et al., Cell, 2017/ DOI: http://dx.doi.org/10.1016/j.cell.2017.07.010
Технология редактирования генома CRISPR/Cas9 в последнее время постепенно приходит в клиническую практику. Пока большинство ученых не рискует применять ее для внесения перманентных, наследуемых изменений в геном, хотя лабораторные эксперименты в этом направлении проводятся уже не только в Китае, но и в США. Большинство методов терапии сосредоточено на внесении ненаследуемых изменений в соматические клетки либо на еще более мягкой версии метода — действия на уровне РНК.
Источник https://nplus1.ru/