Новые инструменты генных инженеров, всем спорам вопреки, выводят на первый план способность генной терапии спасать жизни людей.
Первые эксперименты по редактированию генов в геномах живых существ датируются началом XX в. К середине XX в. ученые уже умели достаточно точно модифицировать гены бактерий, но для того, чтобы научиться вносить такие изменения в гены человека, понадобилось еще несколько десятилетий.
После первых же успехов начались споры об этической приемлемости редактирования генома человека, и они не утихают до сих пор. Однако, похоже, что этот джинн уже выпущен из бутылки и его не удастся затолкнуть обратно. Сейчас редактирование генома вступило в этап технологической гонки. Некоторые виды генной терапии уже разрешены к использованию в медицинской практике, некоторые — проходят клинические испытания.
Самые проворные: «цинковые пальцы»
Медицинской сенсацией ноября стало сообщение из Калифорнии о том, что там впервые в мире отредактировали геном прямо в теле человека. Не из абстрактного научного интереса, а чтобы избавить пациента от тяжелой болезни.
44-летний Брайан Маде всю свою жизнь борется с мукополисахаридозом II типа. Это заболевание, называемое также синдромом Хантера, имеет генетическую природу и до сих пор считалось неизлечимым. Его причиной является мутация в гене, ответственном за производство фермента, который участвует в расщеплении сложных углеводов. В итоге они накапливаются в клетках и вызывают многочисленные патологии органов.
Для людей с синдромом Хантера характерны задержка роста, плохая подвижность суставов, диспропорциональное строение тела и огрубление черт лица. Также болезнь создает трудности с дыханием и вызывает увеличение внутренних органов, например печени или селезенки. Недостающий в организме фермент можно добавлять внутривенно, но для этого необходимо ездить в больницу на еженедельные процедуры. К тому же этот вид терапии способен только облегчить симптомы, а стоит он до $400 тыс. в год.
Брайану Маде за его жизнь пришлось перенести 26 операций — из-за грыж и деформированных костей, а также на позвоночнике, глазах и желчном пузыре. По словам мужчины, вся его жизнь словно состоит из операций и медицинских процедур. В прошлом году он чуть не умер от бронхита и воспаления легких: Маде не мог откашливаться, так как у него деформированы дыхательные пути.
Несмотря на болезнь, Маде вел активную жизнь, стал шеф-поваром и совладельцем двух ресторанов. Но в последнее время плохое состояние здоровья не позволяло ему работать. Поэтому он и решил принять участие в проводимом компанией Sangamo Therapeutics клиническом испытании нового метода лечения синдрома Хантера. Этот метод борется не с симптомами, а с причиной болезни. Он использует редактирование генома с помощью ZFN — белков-нуклеаз, называемых «цинковыми пальцами» (этот белок действительно содержит ион цинка и по форме похож на палец).
Генная терапия считается одним из перспективных способов борьбы с тяжелыми заболеваниями. Например, в мае 2016 г. в Европе одобрили генную терапию тяжелого комбинированного иммунодефицита, а в августе 2017 г. FDA (Администрация продовольствия и медикаментов США) одобрила разработанную корпорацией Novartis генную терапию для лечения острого лимфобластного лейкоза у детей и молодых людей в возрасте до 25 лет. Как правило, у пациента берут клетки, в лаборатории встраивают в ДНК этих клеток необходимый ген и затем вводят их обратно пациенту.
Таким же образом до сих пор осуществлялось и редактирование генома с помощью ZFN, которое, стоит сказать, используется еще с 1990-х и является одной из старейших технологий генной терапии. Новый метод, который использовали для лечения Маде, отличается тем, что он позволяет редактировать геном прямо в теле человека и при этом достаточно точно попадать в конкретный участок ДНК. «Цинковый палец» способен найти нужный участок ДНК и связаться с ним, чтобы можно было внести в это место необходимые изменения. Как объяснил президент Sangamo Сэнди Макрэ, это что-то вроде «внедрения в организм крошечного хирурга», который сам «разрезает вашу ДНК, вставляет ген и зашивает. Ген становится частью ДНК и остается в ней навсегда».
Процедура, проведенная Брайану Маде 13 ноября, стала первым случаем, когда человеку сразу вводят через капельницу (с помощью специального раствора) недостающий ген — точнее, миллиарды его копий вместе с «цинковыми пальцами», которые должны вставлять их в ДНК. Для успеха лечения необходимо, чтобы как минимум в 1% клеток печени заработала правильная копия гена.
По утверждению комиссии Национального института здоровья США, одобрившей это клиническое испытание, все предыдущие испытания этого метода на лабораторных животных были многообещающими, поэтому процедура не должна быть опасной. Первые результаты у Маде должны быть заметны уже через месяц, а через три месяца анализы смогут подтвердить, удалось ли ученым избавить мужчину от синдрома Хантера. Если процедура редактирования генома Маде пройдет успешно, это не исправит те изменения, которые уже произошли в его теле. Но проходить ферментную заместительную терапию ему больше будет не нужно.
Кроме Маде, в клиническом испытании нового метода примут участие еще 29 взрослых людей. Это лишь первая фаза исследования, а всего до регистрации терапии (то есть до разрешения применять этот метод для всех больных с синдромом Хантера) их должно быть три. Если лечение окажется эффективным, то в будущем его надеются применять и для детей, чтобы предотвратить необратимые изменения. Сейчас в мире живут с синдромом Хантера около 10 тыс. человек.
При удачных результатах Sangamo планирует провести такую же процедуру пациентам с другими заболеваниями. Например, с гемофилией B и фенилкетонурией.
Самые острые: «генетические ножницы»
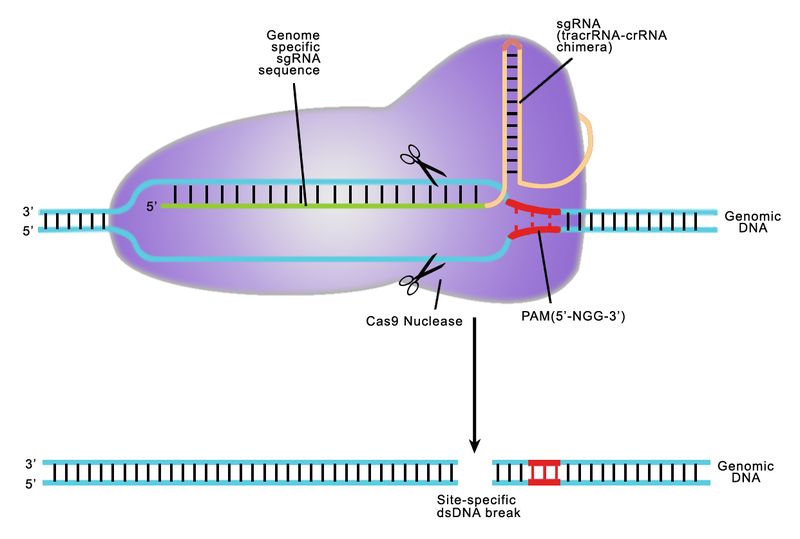
В последние пять лет самым многообещающим инструментом генной терапии считается система CRISPR-Cas. Она была открыта в конце 1980-х у бактерий и, как выяснилось в 2005 г., служит у них защитным механизмом от вирусов. В число элементов системы входят и белок Cas9, который разрезает вирусный геном в нужном месте, и короткая направляющая РНК, которая сообщает Cas9, где делать разрез. Эти белок и РНК кодируются особыми участками бактериальной ДНК, получившими название CRISPR (расшифровывается как «короткие палиндромные повторы, регулярно расположенные группами»).
Оказалось, что эту систему можно приспособить для редактирования генома самых разных клеток, в т. ч. и человеческих. С 2012 г. технология CRISPR-Cas активно испытывается в многочисленных экспериментах. В 2015 г. она получила премию «Прорыв года» журнала Science — одну из самых престижных наград в области науки. Также это открытие уже несколько лет называется в числе фаворитов на Нобелевскую премию.
ZFN, CRISPR-Cas, другие технологии редактирования генома конкурируют друг с другом и их соперничество, похоже, стимулирует их к развитию и усовершенствованию. Пока в Калифорнии учатся применять ZFN прямо в теле человека, на другом конце США придумали новый способ доставки элементов системы CRISPR-Cas к месту назначения в геноме.
Обычно белок Cas9 и направляющую РНК помещают в безопасный вирус, который проникает в клетку и доставляет эти «генетические ножницы» к участку ДНК, нуждающемуся в редактировании. Однако у этого метода есть недостаток: иммунная система может выработать антитела против вируса, и это снизит эффективность терапии. 13 ноября Массачусетский технологический институт (MIT) сообщил, что его специалисты разработали новый способ доставки, обходящийся без вирусов.
Вместо вирусов ученые MIT использовали наночастицы и, упаковав в них Cas9 и РНК, доставили их в печень взрослой мыши. Мишенью эксперимента был ген, регулирующий уровень холестерина и связанный с некоторыми расстройствами, из-за которых накапливается вредный холестерин. Ученым удалось удалить этот ген в 80% клеток печени. Это лучший результат, который когда-либо достигала технология CRISPR-Cas в опытах на взрослых животных. После процедуры уровень холестерина в крови мыши снизился на 35%.
«Полностью синтетическая наночастица, которая целенаправленно отключает гены, может стать мощным инструментом в медицине, — говорит Дэниэл Андерсон, главный автор статьи, опубликованной в журнале Nature Biotechnology. — Печень — очень важный орган, но также и источник болезней для многих людей. Если мы сможем перепрограммировать ДНК в клетках печени, не мешая ее работе, мы сможем решить проблему многих заболеваний».
Самый точный: «генетический скальпель»
Однако и технология CRISPR-Cas со всеми ее модификациями уже не является последним словом в науке. Различные группы исследователей ищут более эффективные способы редактирования генома, и некоторые заявляют, что уже нашли. Правда, до испытаний этих способов на человеке еще далеко.
Так, Йельский университет 16 ноября сообщил о создании более точной и эффективной технологии редактирования генома, которая позволяет избавиться от недостатков современных технологий. «Существующие технологии можно сравнить с пилой-ножовкой, а нашу — со скальпелем, который позволяет совершать точные генетические изменения с высокой эффективностью во множестве мест генома», — говорит старший автор опубликованной в журнале Cell статьи Фаррен Айзекс.
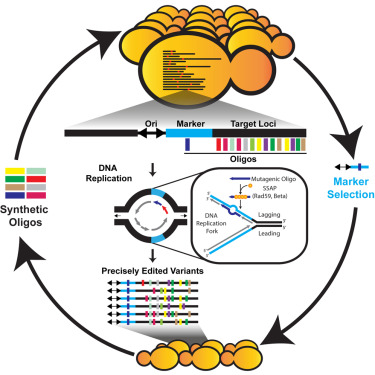
Современные технологии обычно разрезают двойную спираль ДНК, чтобы внедрить генетические изменения, и рассчитывают, что клетка с помощью собственных молекулярных механизмов сошьет этот разрыв. Однако иногда эти разрывы остаются неисправленными или же при их сшивке возникают ошибки в последовательности генов. Команда ученых из Йеля научилась внедрять новую генетическую информацию без многочисленных разрывов двойной спирали. Новая технология, названная eMAGE («эукариотическая мультиплексная геномная инженерия»), ускорит процедуру замены болезнетворных генов, а заодно облегчит поиск и разработку природных антибиотиков и противораковых агентов и подстегнет создание новых биотехнологических продуктов, утверждает Айзекс.Он и его группа уже создали почти миллион вариантов внедрения точных генетических изменений, которые перенастраивают экспрессию генов и метаболизм. «Мы можем создавать множество комбинаций, — подчеркивает Айзекс. — Это дает нам беспрецедентный инструмент для выявления мутаций и перепрограммирования клеточного поведения».
Впрочем, до сих пор ученые из Йеля испытывали свой инструмент только на одноклеточных организмах, таких как дрожжи. Теперь, говорит Айзекс, взгляды его команды направлены на дальнейшее развитие технологии и распространение ее на многоклеточные организмы.
Самый умный: «генетический карандаш»
Задачу повышения точности редактирования генома поставили перед собой и ученые Гарвардского университета. Как стало известно в октябре из публикации в журнале Nature, они создали такой инструмент, который, в отличие от CRISPR-Cas, не разрезает цепочку нуклеотидов, а точечно заменяет в ней исключительно все самое необходимое, не разрушая при этом общую структуру. Делается это при помощи особого фермента, позволяющего менять в ДНК отдельные пары азотистых оснований.
Ученые надеются, что достигнутая ими точность в редактировании генома позволит в обозримом будущем одержать победу над множеством наследственных заболеваний, например, над серповидноклеточной анемией и муковисцидозом. Пока же исследователи успели опробовать свою революционную методику на ряде бактерий. В их ДНК точечно модифицировали ген, отвечающий за устойчивость к определенному антибиотику. После чего бактерии лишились всяческой защиты от этого препарата и начали погибать. Но ученые решили не останавливаться на этом и провели обратный эксперимент, вернув бактериям прежнюю защиту. Эксперимент также завершился удачей.

Команда из Гарварда считает, что ее инструмент редактирования гораздо более гибкий и эффективный, нежели CRISPR-Cas, и поэтому со временем оттеснит устаревшую систему на второй план. Редактор оснований — это более точный инструмент, говорит один из авторов исследования Дэвид Ли. Он сравнивает CRISPR-Cas с ножницами, а новую технику — с карандашом. Действительно, азотистые основания — это, по сути, буквы ДНК. А придуманный в Гарварде «генетический карандаш» умеет их переписывать.
Каждое основание из одной нити ДНК имеет пару на противоположной нити. Так, аденин (A) соединяется с тимином (T), а гуанин (G) — с цитозином (C). Суть открытия в том, что теперь пару AT можно заменить на GC. Начиная исследование, ученые находились в ситуации, когда подобная операция казалась невозможной, потому что для такой реакции нужен фермент, которого не существовало, но им удалось его получить. В результате редактирование происходит при меньшем числе неожиданных мутаций и ошибок.
Самое простое: «редактирование без редактора»
Еще более радикальное новшество придумал массачусетский стартап Homology Medicines. Он нашел способ осуществлять редактирование генома вообще без вмешательства редактора. То есть никаких генетических инструментов не нужно — ни «пальцев», ни «ножниц», ни «скальпеля», ни «карандаша».
Оказывается, функцию редактора с успехом может выполнять сама ДНК, которую необходимо исправить. Для этого нужно только доставить к ней (обычно это делается с помощью безвредного вируса) правильный ген, который надлежит заменить на неправильный, и дальше ДНК сама произведет замену в ходе репликации при делении клетки. Кстати, это выяснил еще в 1998 г. Дэвид Рассел из Университета Вашингтона в Сиэтле.
Загвоздка в том, что такое явление случается редко. В некоторых типах клеток такому саморедактированию подвержена только одна из тысячи клеток. Этого явно недостаточно для того, чтобы лечить большинство заболеваний, поэтому эта технология никогда раньше не рассматривалась всерьез как вариант терапии.
Однако в мае 2017 г. на ежегодном собрании экспертов по генной и клеточной терапии исследователи из Национального медицинского центра «Город надежды» в городе Дуарти, штат Калифорния, заявили, что нашли вирусы, при использовании которых для доставки правильных генов саморедактируются 50% клеток. Впрочем, секрет своего ноу-хау группа не сообщила, а ее научный руководитель Сасвати Чаттерджи основал стартап Homology Medicines, который, по сообщению MIT Technology Review, уже к концу августа собрал впечатляющие $127 млн для лечения генетических заболеваний с помощью новой технологии.
«Если заявление о 50% — правда, то это будет самая лучшая технология для редактирования генома», — говорит Дэвид Рассел, который открыл клеточное саморедактирование 19 лет назад. Но он добавляет, что результат слишком хорош, чтобы быть правдой, а привлеченные стартапом миллионы долларов объясняет «неистовым ажиотажем вокруг генного редактирования».
Несколько других экспертов сказали, что они тоже настроены скептически к заявлению группы Чаттерджи. «Многие из нас в аудитории не были уверены, что то, что они утверждали, было подтверждено данными, которые они представили», — говорит Мэттью Портеус, специалист по редактированию генома из Стэнфордского университета, присутствовавший на майском собрании. Правда, он работает над технологией CRISPR, так что ему положено быть скептичным к успехам конкурентов.
13 ноября о своем сотрудничестве с Homology Medicines объявила фармацевтическая корпорация Novartis (та самая, которая в августе первая в США получила от FDA разрешение на генную терапию). Целью сотрудничества названа адаптация технологии Homology к лечению болезней крови и некоторых глазных заболеваний. Биологи Novartis будут работать бок-о-бок с учеными Homology для продвижения проектов к клиническим испытаниям, говорится в сообщении.
В свою очередь, стартап рассказал, что Novartis в соответствии с условиями соглашения внесла авансовый платеж и инвестиции в акционерный капитал Homology. Кроме того, Novartis предоставляет финансирование для продвижения программ и изучения новых возможностей технологии Homology. Стартап также будет получать оплату от Novartis и роялти от продажи продуктов, созданных в рамках сотрудничества.
Наверное, дело все же не только в ажиотаже. Да и Novartis вряд ли стала бы покупать кота в мешке. Действительно ли технология Homology совершит переворот в генной терапии, это должно выясниться в ближайшие несколько лет.
Вместо итогов. Джинн уже вне бутылки
Можно заключить, что конкуренция в этой отрасли биотехнологий будет и далее нарастать. Людям будут предлагаться все более эффективные и притом разнообразные виды генной терапии, цена которых, по-видимому, будет падать, а доступность — расти.
По-видимому, изменится и характер споров об этической приемлемости редактирования генома человека. Хотя, конечно, по-прежнему какая-то часть людей будет отвергать этот метод как таковой, но все же самым острым станет вопрос о черте дозволенного.
Эксперт по биоэтике Алта Чаро утверждает, что наши страхи очень преувеличены. Она вспоминает, что более 40 лет назад такие же дебаты вызывала другая генетическая технология — амниоцентез, то есть анализ околоплодных вод и ткани плаценты. Он применяется, в частности, для выявления синдрома Дауна. В свое время амниоцентез заставлял многих врачей и этиков беспокоиться, не слишком ли мы одержимы погоней за совершенством и не рассматриваем ли детей в качестве товара. История показала беспочвенность этих опасений.
В 1980-х пугалом для общественности стало экстракорпоральное оплодотворение. Многим казалось, что вот-вот станет реальностью будущее в духе научной фантастики, в котором детей выращивают в пробирках в соответствии с заданными свойствами. Но сегодня ЭКО используется прежде всего партнерами, которые не могут достичь беременности естественным путем, и родителями, которые не хотят передавать ребенку опасные генетические заболевания.
Чаро оптимистична и верит в нравственность человечества, но при этом полагает, что без четкого биоэтического законодательства не обойтись. Вот только в том-то и вопрос, где провести черту дозволенного. На первый взгляд, тут все просто: черта должна пролегать между спасением жизни и безответственной прихотью, например, желанием произвести на свет ребенка, который будет светиться в темноте. Однако расстояние между этими крайними вариантами намного короче, чем кажется.
В самом деле, как различить желание избавить будущего ребенка от «плохого» гена, наделяющего болезнью или физическим дефектом, и намерение дать ребенку «хороший» ген, обеспечивающий превосходство над сверстниками. Ведь если будет разрешено избавляться от «плохих» генов, то родители будут стараться заменять «плохие» гены не на «нейтральные», а именно на «хорошие».
Наверное, кто-то переусердствует в стремлении усовершенствовать будущее чадо. Однако не это будет самой большой проблемой. Да и если наложить тут множество запретов, тогда просто будет процветать черный рынок генно-инженерных услуг.
Самая большая опасность в том, что кто-то где-то может попытаться вывести новый биологический вид, то есть таких «сверхлюдей», которые будут способны скрещиваться только между собой, но не с обычными людьми. Такой проект, скорее всего, будет реализован не в странах свободного мира, а в каком-нибудь тоталитарном государстве, которому потребуются то ли «суперсолдаты», то ли «супергении». Оно точно будет игнорировать любые международные ограничения, а над любыми спорами по биоэтике — смеяться.
Источник http://www.dsnews.ua