Регенеративная медицина — это медицина, направленная на восстановление поврежденных тканей с помощью стволовых клеток. Эта область находится на стыке биологии, инженерии и медицины. Сейчас это одно из самых перспективных и быстроразвивающихся направлений. «Ъ-Наука» побеседовал с Вадимом Зориным, ведущим экспертом в этой области, о его неожиданном открытии, перспективах использования и внедрении в медицинскую практику.
Вадим Зорин, врач-биофизик, кандидат биологических наук, эксперт «Сколково», кластер «Биомед», гендиректор ООО «Витацел», руководитель отдела регенеративной медицины публичной биотехнологической компании ПАО «Институт стволовых клеток человека». Область интересов: регенеративная медицина, клеточные и генно-инженерные технологии, anti-aging.
— Чем ваш подход отличается от распространенных на сегодняшний день практик регенеративной медицины?
— Наш подход ничем не отличается от других подходов современной регенеративной медицины, основная задача которой — восстановление поврежденной ткани с помощью активации эндогенных стволовых клеток, включая трансплантацию ауто- и аллогенных клеток. Одна из концепций последнего направления основана на применении постнатальных стволовых (стромальных) клеток для восстановления структуры и функций поврежденных органов. В качестве главного кандидата в этом направлении рассматривают мезенхимальные стволовые (стромальные) клетки (МСК), входящие в состав соединительной ткани многих органов и являющиеся одним из самых распространенных типов стволовых клеток взрослого организма. Эти клетки можно применять как с дифференцировкой их в нужном направлении, так и без дифференцировки. Преимущество же обнаруженных нами клеток, которые также относятся к МСК, заключается в том, что источник, из которого их можно получить,— легкодоступный, процедура забора биоптата десны мало инвазивна (раневой дефект быстро заживает без образования рубца), полученные клетки легко размножаются и обладают высокой регенеративной способностью, самое же главное — они без дополнительного воздействия сами способны дифференцироваться в миобласты. И это прекрасно, поскольку облегчается задача по поиску действенных терапевтических средств для лечения в том числе и серьезных врожденных заболеваний, например таких, как миодистрофия Дюшенна (МДД).
Следует отметить, что стандартные подходы к лечению некоторых мышечных заболеваний, в частности мышечных дистрофий, в большинстве случаев неэффективны, что в конечном итоге приводит к летальному исходу. Поэтому очень важна разработка биомедицинских препаратов на основе клеток, обладающих высоким миогенным потенциалом. В норме поврежденные мышечные волокна восстанавливаются за счет специфических клеток мышечных волокон — сателлитных клеток (СК). Однако СК являются редкими и малочисленными клетками скелетной мышечной ткани, выделение и размножение которых сопряжены с существенными трудностями. По этой причине очень важен доступный источник клеток, обладающих высоким миогенным потенциалом, а также быстрое «наращивание» этих клеток в необходимом для проведения терапии количестве.
— Вы упоминали, что случайно открыли это свойство клеток десны. Как это произошло?
— Это, конечно, не совсем случайное открытие. В 2005 году наш научный коллектив совместно с сотрудниками ЦНИИС и ЧЛХ проводили пилотные клинические исследования по использованию аутологичных (собственных) фибробластов десны для лечения пациентов с рецессиями десны. В качестве клеточного материала мы использовали культивированные аутологичные фибробласты, выделенные из разных участков десны пациентов. Биоптаты десны (фрагменты ткани размером 2 мм) забирались врачом-стоматологом и доставлялись в лабораторию НИИ канцерогенеза РОНЦ РАМН, где у нашего научного коллектива на тот момент была основная научная база. Из этих биоптатов выделяли фибробласты по стандартной (с некоторыми модификациями) методике, которые затем культивировали, чтобы получить нужное количество клеток. Я решил поэкспериментировать и оставил первичную культуру фибробластов, не меняя питательную среду, дольше, чем обычно, чтобы посмотреть, как поведут себя клетки, сохранят ли жизнеспособность и т. д., то есть естественный интерес исследователя. И вот я в лаборатории — и сразу за микроскоп. Увиденным был просто потрясен: на дне пластикового флакона многоядерные структуры — мышечные трубочки, образующиеся при слиянии миобластов (клеток, образующих мышечные волокна)! То есть я стал свидетелем феномена спонтанной дифференцировки (превращения) стромальных клеток десны в миобласты, ранее никем не описанного.
Впоследствии эксперимент был многократно воспроизведен с использованием различных методов, подтверждающих мышечную природу обнаруженных клеток. В 2014 году, подключив к проекту ученых из ФМБЦ им. А. Я. Бурназяна, мы подали заявку и выиграли конкурс РНФ на грантовое финансирование исследований, направленных на более детальное изучение мышечной природы обнаруженных клеток и возможности лечения с их помощью патологий мышечной системы. Данные о новом источнике мышечных клеток, обладающих высоким регенеративным потенциалом, полученные в рамках этого проекта, были опубликованы в высоко котируемых научных журналах — например, одна из наших статей увидела свет в журнале Сell Cyclе (2017).
Как-то на международной конференции я встретился с группой индийских ученых, которые, как оказалось, внимательно следили за нашими работами, поскольку также занимались фибробластами десны. Эти ученые, поздравив меня, рассказали, что их целью также была дифференцировка фибробластов десны в миобласты, но им повезло меньше, чем нам, ибо они не догадались исследовать фибробласты из разных участков десны и таким образом пропустили этот феномен. Так что, конечно же, наряду с тем, что случай благоприятствует подготовленным, должна быть и доля просто научного везения!
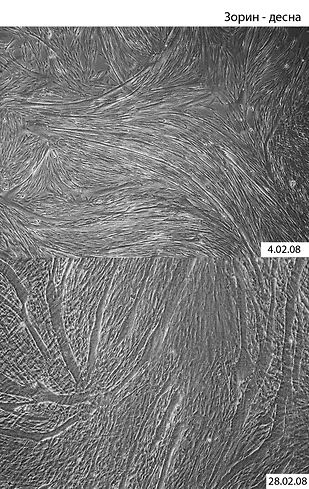
Фото: Предоставлено В. Зориным
— Как вы оцениваете рынок вашей технологии — о каких заболеваниях и о каком числе ежегодных пациентов идет речь?
— Рынок, на наш взгляд, достаточно большой, поскольку по мере старения, а также при ряде врожденных и приобретенных заболеваний в скелетной мышечной ткани у большого количества людей нарушаются процессы ее естественной регенерации, что сопровождается такими серьезными дисфункциями, как мышечные дистрофии, нейромышечные заболевания, саркопения (в том числе и возрастная, которой подвержены практически все люди старше 70 лет), дисферлинопатии и другие миопатии. Таких пациентов, конечно же, много. Но здесь правильнее было бы говорить не столько о количестве, сколько о серьезности этих заболеваний. Так, например, МДД считается самым финансово затратным в мире, на Западе лечение таких пациентов обходится в €600 тыс. в год, в России же препаратов для лечения этих пациентов вообще нет, поэтому на Западе люди с таким заболеванием доживают до 50 лет, а у нас МДД — приговор. В РФ детей с такой патологией на сегодняшний день около 4 тыс. Поэтому, естественно, очень важна и очень актуальна разработка методов, направленных на регенерацию мышечных тканей, особенно на основе клеток из легкодоступного источника с высоким миогенным и регенеративным потенциалом.
— Есть ли у вашего открытия, вашей технологии направления-конкуренты — в России или за рубежом?
— Конечно, есть, например, в России наши коллеги из Института стволовых клеток человека (Москва) занимаются разработкой генно-терапевтических препаратов для лечения пациентов с дисферлинопатией. За рубежом же «РегенМед» сильно продвинулся за последние годы, там основной акцент ученые делают на редактировании генома с помощью системы CRISPR/CAS9, получившей только что Нобелевскую премию, и ее аналогов). Но мы абсолютно уверены, что чем больше будет разработано продуктов, тем выше шанс найти самый оптимальный и не очень затратный подход к лечению пациентов с патологией мышечной ткани.
— Какие у вашего метода есть проблемы, которые нужно преодолеть, чтобы масштабировать его до внедрения в медицинскую практику? Сможет ли Россия поставлять эту технологию на мировой рынок, есть ли за рубежом к ней интерес, хотя бы потенциальный?
— Самое сложное на сегодня — проведение доклинических и клинических исследований согласно закону №180-ФЗ «О биомедицинских клеточных продуктах (БМКП)», которое требует сертифицированного производства. Регуляторными органами создан нормативно-правовой фундамент по обращению БМКП, который, по общему мнению специалистов «РегенМед», трудновыполним, если не сказать, невыполним вовсе. На регистрацию БМКП может уйти от трех до пяти лет и более 500 млн руб. по нынешнему курсу доллара (все — оборудование, реактивы, культуральный пластик — импортное, и цены привязаны к курсу доллара или евро). И это на сегодняшний день основная проблема для любого научного коллектива, который разрабатывает клеточный продукт.
Трансфер же технологии за рубеж требует еще больших затрат и усилий (так, чтобы провести доклинические и клинические исследования за рубежом, требуется до $700 млн). Вот такая незатейливая оценка выхода на рынок. Для начала если нам удастся найти заинтересованных бизнес-партнеров для выхода на российский рынок, то уже будет просто замечательно, а далее поживем — увидим…
Источник https://www.kommersant.ru