
Результаты экспериментов по использованию методов генной терапии для лечения собак с моделью мышечной дистрофии Дюшенна (МДД), полученные учеными Университета Миссури, можно назвать технологическим прорывом и гигантским скачком вперед в лечении этого заболевания.
Причиной мышечной дистрофии является замещение пораженной мышечной ткани тканями других типов – фиброзной, костной или жировой. Мышечная дистрофия Дюшенна (МДД) – наиболее распространенный тип мышечной дистрофии, преимущественно поражающий мальчиков, – обусловлена генной мутацией, нарушающей биосинтез белка дистрофина, необходимого для выживания и функционирования клеток мышц. Отсутствие дистрофина запускает цепную реакцию, которая в конечном итоге приводит к дегенерации и гибели мышечных клеток. Найти ключ к восстановлению синтеза дистрофина ученые пытаются в течение многих лет, но им приходится сталкиваться с множеством проблем.
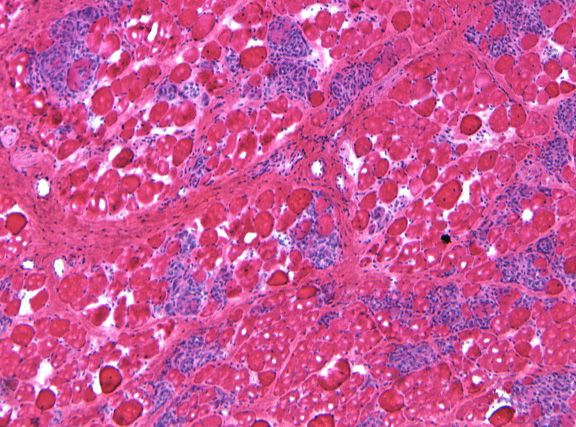
Одним из основных препятствий в лечении мышечной дистрофии Дюшенна методами генной терапии является размер гена дистрофина. Ген дистрофина – самый большой ген человеческого генома, кодирующий примерно 4000 аминокислот. Чтобы упаковать ген дистрофина в вирусный вектор, способный доставить его в нужное место, необходимо удалить 70 процентов гена. Такой до предела «урезанный» ген известен как ген микродистрофина. Предыдущие исследования показали, что микродистрофин может эффективно останавливать заболевание мышц у дистрофин-дефицитных мышей. Однако у таких мышей симптоматика МДД выражена в минимальной степени, и полученные на мышах результаты часто не могут предсказать то, что произойдет в организме человека. В отличие от мышей, у собак потеря дистрофина приводит к тяжелой мышечной дистрофии. Если бы микродистрофин работал в организме больных собак, он, скорее всего, работал бы и в организме человека. К сожалению, предыдущие эксперименты с микродистрофином на собаках не увенчались успехом.
Для преодоления этого препятствия группа во главе с профессором медицинских исследований Школы медицины Университета Миссури Дуншэнь Дуанем сконструировала новый ген микродистрофина, несущий важную функциональную область, которой не было в более раннем варианте этого гена.
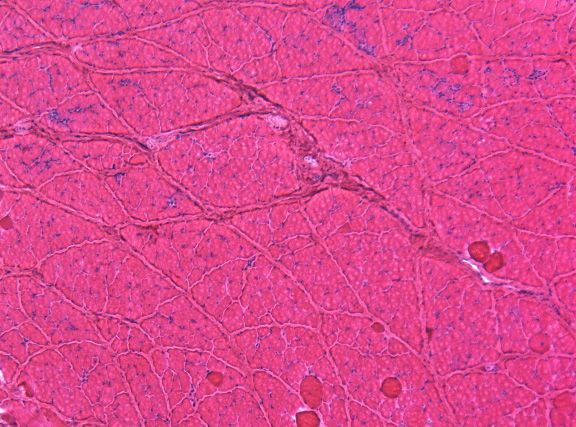
Ученые поместили новый микроген в вирус, ввели вирус в мышцы собак с дистрофией, а затем оценили силу мышц и признаки их поражения, сравнив эти показатели с показателями животных контрольной группы. Тщательный анализ состояния 22 собак показал, что новая версия микродистрофина не только уменьшает воспаление и фиброз, но и значительно увеличивает мышечную силу.
«Это первый случай, когда мы наблюдаем положительные результаты генной терапии на крупных млекопитающих с мышечной дистрофией Дюшенна», — резюмирует профессор Дуань. «Впереди еще очень много работы, но теперь мы знаем, что наша генно-терапевтическая стратегия работает на крупных млекопитающих. Следующим шагом будет проверка нашей стратегии на большой группе мышц собак, а затем, в конечном итоге, на организме собак в целом. До метода, пригодного для лечения пациентов, еще далеко, но, получив эти результаты, я вижу свет в конце туннеля».
Тем временем ученые Института сердца Лиллехея Университета штата Миннесота создали стволовые клетки, способные восстанавливать мышечную ткань в мышиной модели мышечной дистрофии Дюшенна. Достичь этого успеха им помогло сочетание двух передовых биотехнологических методов – генной инженерии и перепрограммирования клеточного генома.
Работа американских исследователей, доказавшая состоятельность самого принципа – сочетания технологии индуцированных плюрипотентных стволовых клеток с генетической коррекцией, – представляет собой значительный шаг в развитии методов лечения мышечной дистрофии Дюшенна и близких к ней заболеваний, основанных на аутологичных клетках. Ученые надеются, что она проложит путь к тестированию данного подхода на человеческих индуцированных плюрипотентных стволовых клетках, полученных из клеток пациентов с этими тяжелыми недугами.
Результаты исследования опубликованы в журнале Nature Communications.
Для достижения столь значимого результата в лечении мышечной дистрофии у мышей, исследователи использовали три новаторские технологии.
Во-первых, они перепрограммировали в плюрипотентные клетки, способные дифференцироваться в любые зрелые типы клеток организма, фибробласты животных. Перепрограммированные фибробласты несли мутации в генах дистрофина и атрофина, вызывающие у мышей развитие тяжелой формы мышечной дистрофии, очень близкой к человеческому заболеванию – мышечной дистрофии Дюшенна. Полученная таким образом модель хорошо имитировала то, что теоретически может происходить в организме человека.
Применение второй технологии стало возможным благодаря коррекционному генетическому инструменту, разработанному в Университете штата Миннесота, – транспозону «Спящая красавица» (Sleeping Beauty Transposon) – фрагменту ДНК, способному встраиваться в геном человека, привнося в него полезные гены. В данном случае ученые использовали «Спящую красавицу» для доставки гена под названием «микроатрофин» в плюрипотентные клетки, которые им нужно было дифференцировать.
Как и дистрофин, человеческий микроатрофин поддерживает силу мышечных волокон и предотвращает их повреждение. Но одно из ключевых различий между этими двумя белками состоит в том, как они воспринимаются иммунной системой реципиента. Появление дистрофина в организме пациентов с мышечной дистрофией Дюшенна может спровоцировать тяжелую иммунную реакцию, так как в «норме» этот белок у них отсутствует. Но у тех же пациентов атрофин остается активным и функциональным и по существу «невидимым» для иммунитета. Эта невидимость позволяет микроатрофину заменять дистрофин и стимулировать процесс образования и восстановления мышечных волокон.

Третья использованная технология – метод получения стволовых клеток скелетных мышц из плюрипотентных клеток – процесс, разработанный лабораторией руководителя исследования Риты Перлингейро (Rita Perlingeiro), PhD.
Метод доктора Перлингейро заключается в использовании белка мышечных стволовых клеток Pax3, который «подталкивает» дифференциацию плюрипотентных клеток в направлении стволовых клеток мышц и позволяет им размножаться в геометрической прогрессии. Затем Pax3-индуцированные мышечные стволовые клетки пересаживаются мышам того же штамма, из клеток кожи которых были получены индуцированные плюрипотентные стволовые клетки.
Сочетание этих технологических платформ позволило ученым получить образующие мышцы стволовые клетки, которые не отторгаются иммунной системой организма. Образуя функциональные мышцы и реагируя на повреждение мышечных волокон, пересаженные клетки хорошо зарекомендовали себя у мышей с мышечной дистрофией.

«Мы были очень рады видеть, что вновь образовавшиеся мышечные волокна экспрессируют маркеры коррекции, включая атрофин», — комментирует результаты экспериментов доктор Перлингейро, адъюнкт-профессор Медицинской школы Университета Миннесоты. «Тем не менее, очень важным вопросом было, способны ли эти трансплантированные откорректированные клетки к самообновлению и производству – в дополнение к новым мышечным волокнам – новых мышечных стволовых клеток».
К счастью, эти опасения ученых не подтвердились: эксперименты на мышах с поврежденными новыми мышечными волокнами показали, что клеточные трансплантаты обеспечили животных-реципиентов полностью функциональными мышечными стволовыми клетками.
Этот проект доказывает состоятельность концепции объединения технологии индуцированных плюрипотентных стволовых клеток и коррекции генома методами генной инженерии при лечении мышечной дистрофии.
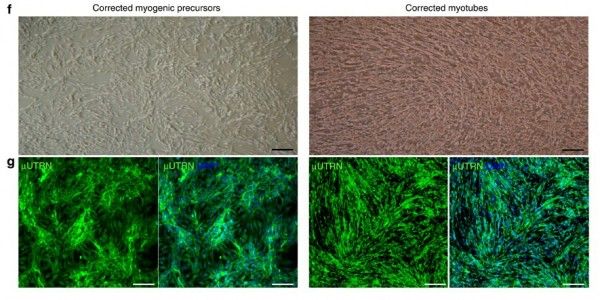
«Применение откорректированных индуцированных плюрипотентных стволовых клеток для восстановления функций доказало свою эффективность при этом генетическом заболевании», — убежден постдокторант лаборатории профессора Перлингейро Антонио Филарето (Antonio Filareto), PhD, ведущий автор статьи. «В разработке возможных методов лечения мышечной дистрофии начался захватывающий период».
Эксперименты американских ученых прокладывают путь к тестированию данного подхода на перепрограммированных человеческих плюрипотентных стволовых клетках, полученных из клеток пациентов с мышечной дистрофией.
«В краткосрочной перспективе важнейшими этапами, как для всей этой области, так и для нашей лаборатории, будут разработка методов генетической коррекции мышечной дистрофии в клетках человека и демонстрация эффективности мышц, развившихся из таких клеток. Тестирование на животных моделях имеет большое значение для разработки эффективных методов, но фокус нашего внимания остается на применении этих технологий на человеческих клетках и подготовке условий для проведения клинических испытаний», — подводит итог доктор Перлингейро.
Источник: LifeSciencesToday



