На конференции «Генная терапия: настоящее и будущее» в декабре прошлого года вы рассказывали о ваших работах по геномному редактированию методом CRISPR-Cas9 для исправления мутаций наследственных заболеваний. Как давно вы работаете с технологией CRISPR-Cas9, с чего все началось?
Мы начали работать с CRISPR-Cas9 с 2016 года. Тогда в нашей лаборатории мутагенеза сменился заведующий, и мы задумались над сменой тематики. В то время в мире был бум технологии CRISPR-Cas9, которая появилась за несколько лет до этого. Это было очень интересно, в МГНЦ этим никто не занимался, и наш заведующий, Александр Вячеславович Лавров, предложил поработать в этом направлении. Потом так сложилось, что я стала заведовать лабораторией мутагенеза, и, собственно, возглавила эту работу. А с 2019 года мы выделились в отдельную лабораторию редактирования генома.
Что нужно для того, чтобы начать работать с CRISPR-Cas9? Нужно ли было какое-то разрешение? И какое лабораторное оборудование, реактивы?
Нет, никакого разрешения не нужно, так как это исследовательская работа. И никакого специфического оборудования тоже не нужно. Геномное редактирование — это набор методов, достаточно универсальных для любой молекулярно-генетической лаборатории. То есть ПЦР, электрофорез, NGS секвенирование, клеточные работы, клонирование плазмид, трансфекция — все это у нас было. Мы не начинали с нуля. У нас всегда были клеточные работы, у нас всегда была молекулярно-генетическая часть. Еще когда заведующим лабораторией мутагенеза, из которой мы все вышли, был Николай Павлович Бочков, мы занимались генной терапией — на том уровне, на каком тогда ею можно было заниматься. Потом фокус нашей лаборатории сместился на изучение патогенеза хронического миелоидного лейкоза, а с 2016 года мы вернулись к теме генной терапии, и как раз в это время в нашей работе появился CRISPR-Cas9. Мы возобновили работу с плазмидами, с которыми имели дело раньше.
Как технически происходит редактирование генома?
Мы используем плазмиды, в которых содержатся компоненты CRISPR-Cas9 в виде ДНК, экспрессионная кассета с нуклеазой и кассета с гидовой РНК. Гидовые РНК мы подбираем сами и клонируем в плазмиды, а нуклеазы и другие компоненты CRISPR-Cas9 мы обычно получаем от коллег, в том числе за рубежом, например, заказываем на Addgene. Эти плазмиды мы наращиваем в кишечной палочке, затем выделяем и трансфицируем в клетки. Клетки получены от пациентов с наследственными заболеваниями, то есть с мутациями, которые мы хотим исправить. После трансфекции через несколько дней мы выделяем ДНК и оцениваем эффективность редактирования. А затем проводим дополнительные функциональные тесты на клетках, чтобы убедиться в том, что мутация исправлена и белок нормально работает.
Преимущество — стабильный эффект
Чем принципиально отличается редактирование генома от генной терапии?
CRISPR-Cas9 разрезает ДНК в том месте, которое мы указываем с помощью короткой молекулы РНК — гидовой РНК. Затем путем рекомбинации этот фрагмент замещается. Для этого мы даем клетке донорную молекулу, которая содержит правильную последовательность нуклеотидов, эта последовательность вставляется в нужное место. А в случае классической генной терапии мы просто доставляем в клетку правильную копию гена, и все. Она там работает какое-то время.
Хотя генная терапия бывает разная. Все зависит от того, каким способом доставляется правильный ген. Есть вирусные векторы, например, лентивирусные, которые могут копировать правильную копию гена и интегрировать ее в геном клетки. Но эта интеграция происходит в случайное место, поэтому возникает инсерционный мутагенез. И для некоторых типов таких интегрирующих вирусных векторов показано, что при этом могут развиваться лейкозы. Поэтому от них все чаще отказываются и используют неинтегрирующие вирусы. Затем, если мы осуществляем генную терапию в делящихся клетках, то такие неинтегрирующие векторы достаточно быстро элиминируются путем разбавления. Допустим, в каждую клетку попадает сто вирусных векторов, клетка начинает делиться, и в каждой дочерней клетке этих вирусных векторов становится все меньше и меньше, и потом, в конечном итоге, их не остается вовсе. Это ведет к непродолжительному эффекту такой терапии.
Но есть неделящиеся клетки. И если доставлять туда неинтегрирующие вирусные векторы с терапевтическим геном, то они там могут персистировать годами. Так работает, например, Золгенсма, препарат для лечения спинальной мышечной атрофии (СМА). Мотонейроны не делятся, поэтому неинтегрирующий вектор может очень долго в них персистировать, особенно в той форме, в которой его сделали. А сделали его самокомплементарным, поэтому он образует эписому, достаточно стабильную молекулу, и не элиминируется. Это позволяет надолго закрепить терапевтический эффект.
Что касается CRISPR-Cas9, то неважно, каким способом эта конструкция доставлена в клетку. Она сразу делает на уровне ДНК то, что нужно, то есть удаляет какой-то фрагмент гена или замещает какой-то фрагмент гена. И это изменение навсегда остается в клетке и в потомках этой клетки. Поэтому мы так любим геномное редактирование за его преимущество — стабильный эффект.
Верно или нет, что генотерапевтические препараты вводят непосредственно пациенту, а в случае с CRISPR-Cas9 редактируют клетки вне тела пациента и потом уже отредактированные нужно трансплантировать?
Нет, это необязательно. Геномное редактирование может быть использовано как ex vivo, когда у пациента берут клетки, редактируют их, а потом трансплантируют обратно, так и in vivo. При этом в организм больного вводят CRISPR-Cas9, который попадает в нужные клетки в организме и редактирует геном этих клеток. Основное отличие от генной терапии — в том, что вводится не терапевтический ген, а инструмент для изменения эндогенного гена.
Разные болезни — разные подходы
С какими заболеваниями вы начинали работать?
С муковисцидозом. Мы начинали с самой частой мутации (CFTR p.F508del), которая встречается у большинства пациентов, сейчас работаем уже с двумя. Муковисцидоз — на сегодняшний момент неизлечимое заболевание. Для него нет никакой генной терапии, все клинические исследования по генной терапии муковисцидоза провалились. На наш взгляд, CRISPR-Cas9 имеет некоторое преимущество перед классической генной терапией, и в данном случае у него есть перспективы.
Какие клетки вы редактируете для исправления мутаций муковисцидоза?
Мы начинали работать со стволовыми клетками. Идея была в том, что мы их отредактируем, дифференцируем в клетки легких и затем можем трансплантировать пациенту. Но все оказалось гораздо сложнее, чем мы думали. И с трансплантацией оказалось сложнее из-за различных технических и биологических моментов, — и мы отказались от этой идеи в будущем, — и с редактированием стволовых клеток тоже все оказалось очень сложно. Они практически не редактируются. Поэтому сейчас мы изменили объект, с которым это делаем. Теперь мы работаем с базальными клетками легких, а также с легочными и бронхиальными органоидами, которые получаем из стволовых клеток пациента. И на них уже проводим эксперименты с редактированием.
Стволовые клетки пациента вы получаете из фибробластов кожи путем их репрограммирования?
Да, исходно мы используем фибробласты кожи от пациентов. Для получения стволовых клеток мы применяем два коммерческих набора, с нашей точки зрения наиболее безопасных. Первый набор на основе вируса Сендай, который не интегрируется в ДНК клетки. Он только запускает процесс репрограммирования, а потом элиминируется из клетки. Второй набор содержит факторы Яманаки в виде мРНК. Они доставляются в клетку, мРНК никуда не встраивается и со временем разрушается. Таким образом, мы в обоих случаях получаем неизмененные клетки, в отличие от того способа, когда их получают с помощью лентивирусов.
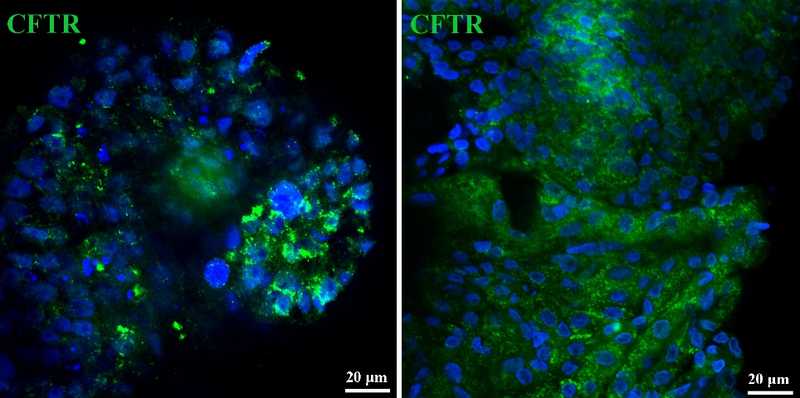
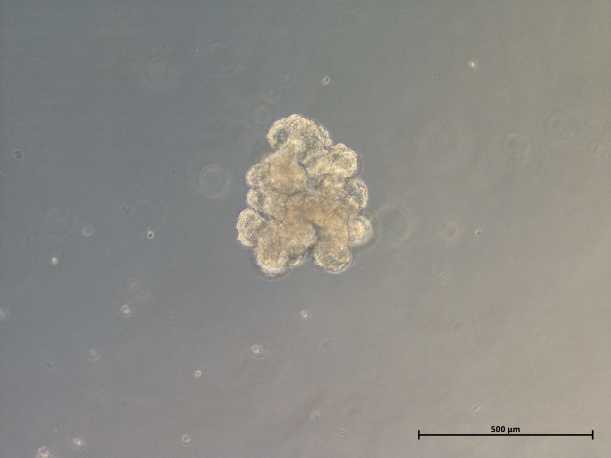
Объектом для редактирования служат клетки легких, потому что легкие — это основная мишень для муковисцидоза? А клеточные органоиды помогают лучше смоделировать эту мишень in vitro?
Да, основная причина смерти при муковисцидозе — поражение легких и легочная недостаточность. Пациенты с муковисцидозом всю жизнь страдают от хронического воспаления в легких и вынуждены постоянно принимать антибиотики и другие препараты, которые их не излечивают. При муковисцидозе поражаются и другие органы, например, поджелудочная железа, но в этом случае довольно эффективна ферментозаместительная терапия, поэтому в первую очередь необходимо купировать легочные симптомы. Органоиды легких — отличная модель легких in vitro. Органоиды состоят из разных типов клеток легких, которые взаимодействуют друг с другом, образуется такой мини-орган. Проводя эксперименты на органоидах, мы можем определить, в какие клетки поступает CRISPR-Cas9, где происходит редактирование, достаточно ли его для терапевтического эффекта.
Мы думаем, что в случае мутаций муковисцидоза CRISPR-Cas9 должен давать более стабильный эффект, чем генная терапия. Осталось только повысить эффективность технологии.
Теперь вы работаете еще и с миодистрофией Дюшенна?
С миодистрофией Дюшенна очень много пациентов, для которых практически нет лечения, а то, которое есть, или малоэффективно, или недоступно, или оно пожизненное. Мы решили применить геномное редактирование для попытки скорректировать мутации при миодистрофии Дюшенна. Там немножко другой подход. Надо ли объяснять, что такое рамка считывания, или ваши читатели это поймут?
Наши читатели поймут.
При миодистрофии Дюшенна есть мутации в гене DMD, которые приводят к сдвигу рамки считывания. Это делеция либо дупликация экзона или нескольких экзонов. Когда нарушается рамка считывания, образуется преждевременный стоп-кодон, такой короткий транскрипт быстро разрушается, и белок не образуется. И есть стратегия, которая не нами придумана, а еще давным-давно за рубежом: пропускать некоторые экзоны, чтобы восстановить рамку считывания. Например, у пациента мутация, у него нет 11-го экзона, при выпадении которого нарушается рамка считывания. Но если мы пропустим следующий 12-й экзон, то 10-й соединится с 13-м, и рамка считывания восстановится. Такой подход, экзон-скиппинг, уже используется для лечения миодистрофии Дюшенна с помощью антисмысловых олигонуклеотидов, которые блокируют сплайсинг этих «ненужных» экзонов.
Но такая терапия — это еженедельная инфузия антисмысловых олигонуклеотидов, потому что они разрушаются в организме очень быстро. Мы же хотели сделать более постоянную терапию, перманентный экзон-скиппинг с помощью CRISPR-Cas9. Он позволяет от этого уйти раз и навсегда, мы просто убираем лишний экзон, 12-й в данном случае, и в тех клетках, где это произошло, восстанавливается рамка считывания. В чем большем количестве клеток это произойдет, тем лучше будет терапевтический эффект. Собственно, на этом построена терапия, которую мы сейчас разрабатываем.
А здесь с какими клетками вы работаете?
С миобластами. Сначала мы потренировались на иммортализованной линии клеток эмбриональной почки человека, в первом приближении посмотрели, работает это или нет. Убедились, что работает. И сейчас мы в процессе получения биопсийных миобластов из мышц пациентов, уже с нужными нам мутациями, чтобы сделать это все на пациентских клетках. Я надеюсь, что этот этап начнется уже скоро.
Есть ли в мире примеры лечения миодистрофии методами геномного редактирования? Вы сказали про антисмысловые нуклеотиды.
Антисмысловые олигонуклеотиды уже одобрены в клинике и даже в России применяются, это препараты Этеплирсен, Голодирсен, они уже используются. По лечению миодистрофии Дюшенна с помощью геномного редактирования в мире было одно клиническое исследование. К сожалению, там участвовал всего один пациент, и он умер, но не от лечения, а просто потому, что случилась прогрессия заболевания. Больше я ничего не слышала про использование геномного редактирования для лечения этой болезни у человека, но развивается генная терапия, классический подход с доставкой правильной копии гена. И сейчас все ждут мая, потому что FDA должен дать ответ, одобряет он первый генотерапевтический препарат для лечения или не одобряет. В его основе — доставка правильной копии гена DMD, но так как этот ген гигантский, то с помощью вирусного вектора доставляется его усеченная форма.

Безопасность и эффективность
Как сейчас обстоит дело с безопасностью метода CRISPR-Cas9? При редактировании ДНК ведь могут возникать ошибки.
Да, ошибки могут происходить, потому что CRISPR-Cas9 режет ДНК. На нужное место указывает гидовая РНК, комплементарная таргетному локусу. Но она коротенькая, комплементарны всего около 20 нуклеотидов. И более того, она толерантна к несовпадению нуклеотидов в определенных своих частях. И возникает возможность того, что CRISPR-Cas9 начинает резать ДНК не только там, где нужно, но и в других местах. Это неспецифическое офтаргетное действие. Возникают двуцепочечные разрывы ДНК, они начинают репарироваться путем негомологичного соединения концов, и дальше все зависит от того места, где это произошло. Если ген кодирующий, то это может приводить к его мутациям и даже к выключению, к нокауту. И возникает опасность серьезных побочных эффектов. То есть, основной вопрос с безопасностью состоит именно в появлении этих неконтролируемых офтаргет-эффектов CRISPR-Cas9.
Можно ли бороться с офтаргет-эффектами и как?
Да, конечно, в мире в этом направлении ведется масштабная работа. В первую очередь совершенствуются белки нуклеазы, используемые в CRISPR-Cas9, их модифицируют таким образом, чтобы они не резали ДНК, если имеется неполная гомология между гидовой РНК и таргетным локусом. Создаются принципиально новые генетические редакторы, в которых ДНК не режется вовсе или делается ник (одноцепочечный разрыв ДНК), это существенно снижает нецелевые изменения в других локусах ДНК. К таким модификациям относят редакторы оснований и праймированное редактирование — более продвинутые версии CRISPR-Cas9. Их офтаргет практически нулевой, а целевая активность сопоставима с оригинальным методом редактирования.
Вы проверяете успешность редактирования секвенированием?
Да, проверяем глубоким таргетным секвенированием, смотрим, в каком проценте случаев происходит исправление мутаций, а в каком проценте случаев происходит внесение новых мутаций в тот локус, который мы редактируем. Пока эффективность не очень высокая — 5% клеток. Мы работаем над тем, чтобы ее повысить.
Какие пути есть для этого?
Эффективность CRISPR-Cas9 очень сильно зависит от того, какой путь репарации включится после того, как нуклеаза Cas9 разрежет ДНК. Двуцепочечные разрывы могут репарироваться двумя путями. Один путь — негомологичное соединение концов, при этом теряются нуклеотиды, попавшие в зону разрыва, возникают новые мутации. Нам этого не нужно. Второй путь — гомологичная рекомбинация, когда разрезанный фрагмент ДНК замещается правильной последовательностью, комплементарной донорной молекулой; для этого клеточные механизмы используют сестринскую хроматиду или же специальную матричную молекулу ДНК, которую мы вводим в клетку одновременно с редактирующей конструкцией. Эти два пути репарации конкурируют между собой. Мы пытаемся повысить эффективность гомологичной рекомбинации, ингибируя факторы, которые участвуют в негомологичном соединении концов. Это два белка — MAD2L2 и TIRR, и их ингибирование – основной путь, который мы используем для повышения эффективности. Кроме того, у нас в прошлом году вышла статья, в которой мы показываем, что эффективность рекомбинации зависит от того, какую донорную молекулу для рекомбинации мы используем, насколько она комплементарна таргетной последовательности, какова ее длина. Мы также показали, как далеко может быть мутация от места двуцепочечного разрыва ДНК, который мы создаем с помощью CRISPR-Cas9.
Почему геномные лекарства дорогие
Как сейчас обстоят дела в мире с лекарственными препаратами на основе технологии CRISPR-Cas9? От каких заболеваний они созданы и на какой стадии исследований находятся?
Лекарственные препараты на основе технологии CRISPR-Cas9 разрабатываются. Как показывает американская база клинических исследований Clinicaltrials.gov, сейчас проводится около 70 клинических исследований с использованием этой технологии. Примерно половина из них — это лечение онкологических заболеваний. Если говорить о наследственных болезнях, то тут исследования проводятся в первую очередь для гемоглобинопатий, наследственного амилоидоза, амавроза Лебера и других. Наиболее близок к одобрению препарат CTX001 для лечения бета-талассемии и серповидно-клеточной анемии. Это терапия ex vivo. У пациента забирают гемопоэтические стволовые клетки, в них осуществляют нокаут гена BCL11A, в норме подавляющего синтез фетального гемоглобина. При нокауте гена BCL11A фетальный гемоглобин начинает синтезироваться и замещает собой поврежденный из-за мутаций гемоглобин. Ппредварительные результаты этих исследований очень обнадеживают.
Значит ли это, что в данных случаях проблемы с безопасностью CRISPR-Cas9 были решены?
Я думаю, что они не решены на сто процентов, но снижены до фонового значения. Когда клетка делится, в процессе репликации ДНК накапливаются ошибки, и этот спонтанный мутагенез составляет какие-то доли процента. Я думаю, что при CRISPR-Cas9 редактировании разработчики препаратов не вывели офтаргет в ноль, а скорее просто довели до спонтанного уровня мутагенеза, считая такой уровень ошибок допустимым. Вероятно, там какие-то ошибки есть, но они минимальны.
Что касается зарегистрированных генотерапевтических препаратов, таких как Золгенсма, основная проблема состоит в том, что они невероятно дорогие. Это объясняется себестоимостью их разработки?
Это объясняется тремя факторами. Во-первых, себестоимостью разработки, потому что создать химическую формулу какого-то лекарства гораздо проще и дешевле, чем провести генотерапевтические исследования с клетками — это очень сложная процедура, и дорогостоящая, и трудоемкая. Во-вторых, это объясняется количеством пациентов, для которых предназначена терапия. Если создается препарат для лечения сахарного диабета, например, то его купят несколько миллионов людей. А Золгенсму купят 20 человек. Кроме того, как заявляют производители, это одноразовое введение, достаточно одной инъекции в течение жизни. И получается, что конечных потребителей лекарства в принципе очень мало, а стоимость разработки делится на их количество. Есть еще третий механизм, который может вносить вклад в цену генотерапевтического лечения: это затраты на ежегодную поддерживающую терапию для каждого пациента. В случае Золгенсмы учитываются затраты на поддерживающую терапию для пациентов со СМА в течение нескольких лет, а то и пожизненно. Стоимость этой пожизненной терапии для пациентов без генной терапии задает такую планку, ниже которой не может стоить генотерапевтический препарат.
Препараты на основе CRISPR-Cas9 технологии будут столь же дорогими?
Думаю, что да. Я не вижу предпосылок к тому, что они должны быть дешевле.
И это касается, в перспективе, тех препаратов, над которыми вы сейчас работаете?
Скорее всего, да. Но опять же будет зависеть от заболевания. Например, муковисцидоз — заболевание гораздо более распространенное, чем СМА, а значит, больше пациентов, которые могут быть вылечены этим методом. Поэтому, скорее всего, стоимость препарата для муковисцидоза будет ниже, чем стоимость препарата для СМА. Но это предположение, я совсем не экономист.
«То, что нам кажется безвредным, на самом деле может быть не безвредным»
Не могу не спросить, каково ваше мнение о попытке редактирования эмбрионов человека? Что вы думаете об опыте Хэ Цзянькуя и о заявлениях Дениса Ребрикова?
Ну, Денис Ребриков как-то попридержал коней, больше он громогласно не освещает свои эксперименты. Я согласна с официальной позицией МГНЦ, что эти эксперименты преждевременны. Этот офтаргетный эффект, про который я говорила, он есть, от него никуда не деться. А когда мы редактируем эмбриональные клетки — эмбрионы или половые клетки, из которых будет потом получен эмбрион, то там вообще по-другому работает репарация ДНК, нежели в соматических клетках. И это приводит к большему количеству ошибок.
После того как мы вводим CRISPR-Cas9 в зиготу, зигота делится на две, четыре клетки и так далее, и в каждую клетку попадает CRISPR-Cas9. В процессе того, как развивается многоклеточный организм, где-то он продолжает работать, где-то исправляет мутацию, где-то создает новые. Мы получаем мозаичный эмбрион, и это создает сложности при ПГД-диагностике, если мы хотим оценить, возникли ли ошибки при редактировании. Когда мы берем у эмбриона какие-то клетки на биопсию, совсем не факт, что это именно те клетки, в которых произошли ошибки. И, во-первых, из-за этого мы можем получить ложные результаты. Во-вторых, наши методы полногеномного секвенирования, которые сейчас используются в ПГД-диагностике, не абсолютно совершенны, мы можем пропустить достаточно серьезные мутации.
И третья проблема — даже если мы что-то нашли, мы не всегда можем это правильно интерпретировать. Сейчас нам кажется, что это безвредная мутация, а через год докажут, что она приводит к какому-то заболеванию с отсроченным возникновением, где-нибудь после пятидесяти лет. И теперь эта мутация пересмотрена и считается патогенной. Все время происходят клинические пересмотры экзомов.
У нас диагностическое учреждение, поэтому мы проводим диагностику наследственной патологии у детей. В некоторых случаях клиническая картина по симптомам очень сложна, и проще секвенировать экзом или геном и посмотреть все мутации, которые есть. Какая-нибудь из них сможет объяснить клиническую картину. Но бывает и так, что ничего патогенного не нашли, а через год пересмотрели результаты, и выяснилось, что за этот год вышло несколько статей, в которых описали связь мутации и патологического процесса, и теперь мы можем сказать, что это причина заболевания. Поэтому, когда мы диагностируем какие-то мутации у эмбриона и находим что-то, что нам кажется безвредным, на самом деле это может быть не безвредным.
Как вам работается сейчас? За последний год у вас возникли какие-либо сложности с приобретением оборудования, реактивов и прочие?
Я, наверное, покривлю душой, если скажу, что нет сложностей вообще. Сложности есть. Мы привыкли к зарубежным реактивам, которые сейчас можно купить, но дороже, чем мы покупали год или два года назад. Хотя достать их можно. Сейчас, чтобы сэкономить, мы пытаемся перейти на российских производителей. Иногда они действительно производят хорошие вещи, хорошие реактивы, но в большинстве случаев качество не очень. Поэтому мы сталкиваемся с рядом проблем. Если мы используем не хорошие, а средние реактивы, то мы вынуждены, допустим, несколько раз повторять эксперимент, чтобы точно убедиться, что получаем правильные результаты. Помимо повышения цены, увеличились сроки поставки. Но в целом нерешаемых проблем нет. Все стало дольше и дороже, но в принципе доступно.
Источник pcr.news



