Последние достижения науки открыли человеку доступ к святая святых — к «коду жизни», или ДНК, обеспечив практически безграничные возможности для перестройки любого живого организма. Готовы ли мы принять такой дар от ученых?
Окинув беглым взглядом офис Энтони Джеймса, нетрудно догадаться, чем он занимается, — все стены завешаны изображениями комаров, а полки уставлены книгами об этих насекомых.
Над рабочим столом красуется плакат, на котором наглядно представлены все стадии развития комара Aedes aegypti: вылупление личинки из яйца, ее последующее окукливание и превращение во взрослую особь. Масштаб изображения заставит содрогнуться даже заядлых любителей триллеров о кровожадных насекомых-гигантах. На номерном знаке машины Энтони тоже гордо отштамповано непонятное непосвященным сочетание букв — AEDES.
«Три десятка лет я буквально помешан на комарах», — рассказывает Энтони Джеймс, молекулярный генетик из Калифорнийского университета (Ирвайн). В природе встречается около 3,5 тысячи видов настоящих комаров, но Энтони интересуют лишь самые смертоносные из них. Один из ярких примеров — малярийный комар Anopheles gambiae — переносчик болезни, ежегодно уносящей жизни сотен тысяч человек.

Биогеографы полагают, что эти комары попали в Америку из Африки на кораблях работорговцев в XVII веке и принесли с собой желтую лихорадку, от которой в те времена в Новом Свете погибли миллионы людей. В наши дни эти насекомые стали переносчиками еще и лихорадки денге, которой ежегодно заражаются около 400 миллионов человек, вирусов чикунгунья, Западного Нила и Зика. (Последний разбушевался в прошлом году в Бразилии и Пуэрто-Рико, что привело к вспышке целого ряда заболеваний нервной системы. В их числе и довольно редкий недуг — микроцефалия: дети рождаются с непропорционально маленькой головой и недоразвитым мозгом.).
Основная цель, которую ставит перед собой группа Энтони, — подобрать ключ к геному комаров и сделать так, чтобы те не смогли распространять опасные болезни. До недавних пор его команда продвигалась по тернистому пути теоретических исследований практически одна. Все изменилось с появлением новой революционной технологии — CRISPR/Cas9: изыскания Энтони наконец обрели практическую основу.
CRISPR/Cas9 — две составляющие генной системы бактерий, отвечающие за иммунитет этих мельчайших существ. Первая представляет собой расположенные регулярными группами короткие палиндромные повторы ДНК (по-английски, cluster regularly interspaced short palindromic repits, или сокращенно CRISPR), между которыми сидят спейсеры (буквально: «разделители»).
Спейсеры, по сути, представляют собой участки генов вирусов и выполняют роль своего рода картотеки генетических «отпечатков пальцев» этих главных врагов бактерий. А Cas9 — белок, который с помощью направляющей РНК — копии того или иного спейсера — сверяет фрагменты вирусной ДНК, уже имеющиеся в «картотеке», с инородными молекулами, оказавшимися в клетке. И, если совпадение обнаружено, разрезает ДНК пытавшегося внедриться в клетку вируса, лишая его возможности размножаться.
Оказалось, что Cas9 можно приспособить для работы с любой направляющей РНК, а значит, этот белок можно нацелить на разрезание любой последовательности ДНК, являющейся аналогом этой РНК. Когда разрез в заданной части ДНК произведен, остается лишь вставить в зазор нужный ген (а можно ничего нового не вставлять, достаточно удалить ненужное старое). Дальше все делает сама клетка (причем не только бактериальная!): для нее устранение подобных разрывов — рутинная работа.
Овладев оружием бактерий против вирусов, генетики научились быстро и точно изменять ДНК любого живого организма на планете, и человек не стал исключением. По сути, CRISPR-технология — это скальпель в руках генетика, более острый и более безопасный, чем стальной скальпель хирурга. С помощью нового метода генной инженерии специалисты могут исправить некоторые генетические недуги — отредактировать мутации, приводящие к дистрофии мышц, кистозному фиброзу, даже победить одну из форм гепатита. Недавно несколько групп ученых попробовали использовать новый метод, чтобы «вырезать» гены вируса иммунодефицита (ВИЧ), встроившиеся в хромосомы человеческих клеток — лимфоцитов. Пока рано говорить о новом чудо-средстве от СПИДа, но, по убеждению многих специалистов, оно будет найдено именно благодаря CRISPR-технологии.
Еще одно направление активных поисков — борьба с вирусами свиней, из-за которых до сих пор не удается поставить на поток пересадку органов от животных к человеку. Пытаются найти применение CRISPR-технологии и для защиты видов, находящихся под угрозой исчезновения. Начали проводить эксперименты и по удалению генов из ДНК культурных растений, чтобы отвадить от них насекомых-вредителей. Если этого удастся добиться, человечество перестанет всецело полагаться на ядовитые пестициды.
Ни одно из научных открытий прошлого века не сулило стольких благ — но и не поднимало такого множества этических проблем. К примеру, можно ли редактировать половые клетки? Ведь они содержат генетический материал, передающийся следующим поколениям — детям, внукам и правнукам генетически модифицированных особей — и так до бесконечности. Неважно, какими намерениями при этом будут руководствоваться генетики — желанием ли исправить врожденный недуг, стремлением ли усилить какое-то полезное свойство, — но кто возьмет на себя смелость предсказать все последствия от вмешательства в сами основы жизни?
«Если кто-то вдруг отважится на преобразование половых клеток, он должен трижды подумать, — размышляет Эрик Ландер, директор Кембриджского института имени Броуда, возглавлявший нашумевший не так давно проект «Геном человека». — И пока этот смельчак не докажет широкой общественности, что для подобного вмешательства в природу человека есть веские основания, а общество не примет его доказательства, ни о каком глубоком изменении генома и речи быть не может. Однако ученым еще не удалось найти ответы на многие этические вопросы. И я не знаю, кто и когда сможет их дать».
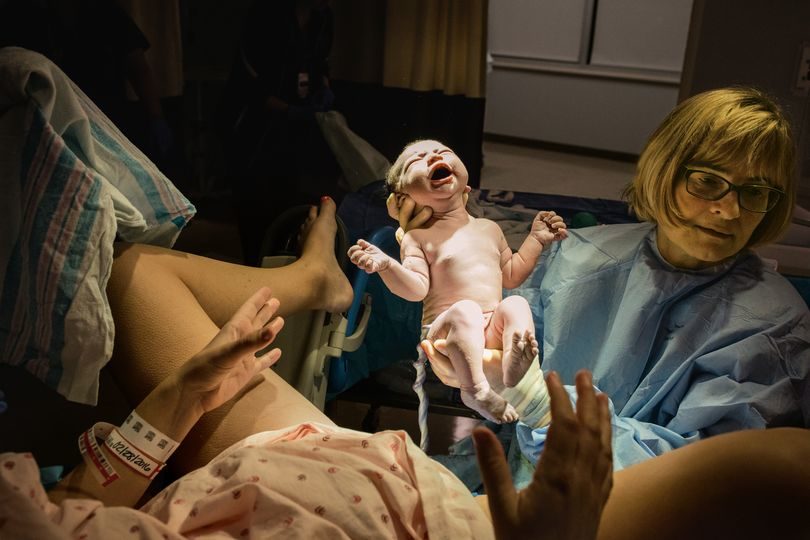
А промедление в данном случае смерти подобно в самом прямом смысле слова. Так, по прогнозам центров по контролю и профилактике заболеваний США, к моменту, когда бушующая в Пуэрто-Рико эпидемия лихорадки Зика пойдет на спад, более четверти из 3,5-миллионного населения острова станут носителями этого заболевания (расчет основан на моделях распространения других патогенов, переносчиками которых являются комары). Это значит, что тысячи беременных женщин рискуют родить неизлечимо больного или нежизнеспособного ребенка.
По-настоящему эффективное решение проблемы на данный момент одно — залить весь остров инсектицидами, которые уничтожат насекомых-переносчиков. [Так в свое время поступили в СССР при строительстве Братской ГЭС. — Примечание российской редакции (ПРР).] Однако Энтони Джеймс предлагает иной способ искоренить болезнь раз и навсегда. Для этого потребуется всего лишь отредактировать геном комаров по технологии CRISPR.
Направленное редактирование генома позволяет обойти «незыблемые» законы наследственности. В природе заведено так, что при размножении половым путем родители передают потомкам по одной копии генов каждый. Однако некоторые гены-счастливчики получили «подарок» от эволюции: их шансы быть унаследованными превышают 50 процентов. Правда, обладатели таких генов вряд ли будут рады подобному дару судьбы: как правило, это гены — носители тяжелых заболеваний. Теперь же — хотя бы теоретически — ученые могут использовать CRISPR-технологию для вырезания из цепочки ДНК дефектных генов. Дальше измененный генотип будет распространяться в популяции естественным (половым) путем.

В прошлом году в журнале Proceedings of the National Academy of Sciences была опубликована статья Энтони Джеймса, в которой он описал применение CRISPR-метода для генетической модификации малярийного комара. «Благодаря вставке определенных генов комары не смогут распространять возбудителей смертоносной болезни, — объясняет Джеймс. — Но при этом больше ничего в их жизни не изменится».
«Я работал в тишине и покое десятилетиями, никто обо мне не знал. Теперь мой телефон разрывается от звонков», — добавляет он, кивком головы указывая на стопку писем, скопившихся на его рабочем столе. Но Энтони прекрасно понимает, что запуск искусственно созданной мутации, спроектированной для быстрого распространения в популяции диких животных, может привести к непредсказуемым последствиям и, возможно, к необратимым изменениям природы. «Распространение насекомых с отредактированным в лаборатории геномом в естественной среде, безусловно, сопряжено с определенным риском, — рассуждает ученый. — Однако, на мой взгляд, бездействие еще опаснее».

Генетики более 40 лет назад научились удалять определенные последовательности нуклеотидов из генома одних организмов и переносить их в другие для изменения природы новых обладателей. Молекулярные биологи предвкушали, какие огромные возможности сулит им метод рекомбинантных ДНК — так назвали новую технологию. Однако энтузиазма поубавилось, когда они осознали, что перенос ДНК между различными видами может привести к неконтролируемому распространению вирусов и других патогенов, а впоследствии — к возникновению заболеваний, от которых не существует природных механизмов защиты. А значит, от этих болезней не будет готовых вакцин.
Непредсказуемое будущее напугало прежде всего самих ученых. В 1975 году на проходившей в Калифорнии Асиломарской конференции молекулярные биологи со всего мира обсудили риски, которые несла генная инженерия, и создали рабочую группу, выработавшую ряд мер по усилению безопасности в экспериментах с геномом.
Вскоре стало ясно, что безопасность приемлемого уровня достижима, а возможности новой прикладной науки превосходят самые смелые ожидания. Генная инженерия начала постепенно изменять к лучшему жизни миллионов людей. Страдающие диабетом получили стабильный источник инсулина: ученые передали бактериям гены, отвечающие за синтез инсулина в человеческом организме, и гигантские колонии генетически модифицированных бактерий превратились в настоящие инсулиновые фабрики.
Благодаря генетической модификации растений появились новые высокоурожайные культуры, устойчивые к гербицидам и насекомым, — начался новый виток зеленой революции.

Получило широкое распространение и лечение при помощи генной инженерии. Лишь пищевая промышленность столкнулась с неприятием обществом тех же самых научных методов. Не помогли и многочисленные исследования, демонстрирующие, что употребление в пищу продуктов, полученных с помощью генетически модифицированных организмов (ГМО), ничуть не опаснее традиционной пищи. Истерия вокруг ГМО подтверждает: люди готовы отказаться даже от тех продуктов питания, которые были признаны безопасными научным сообществом. [И это при том, что несчастные случаи, связанные с употреблением «здоровых» органических продуктов зафиксированы были, а от употребления генетически модифицированных продуктов еще никто не пострадал! Однако благодаря малообразованным политикам, чьи высказывания моментально подхватываются и распространяются в СМИ, у обывателей складывается обратное впечатление. — ПРР.]
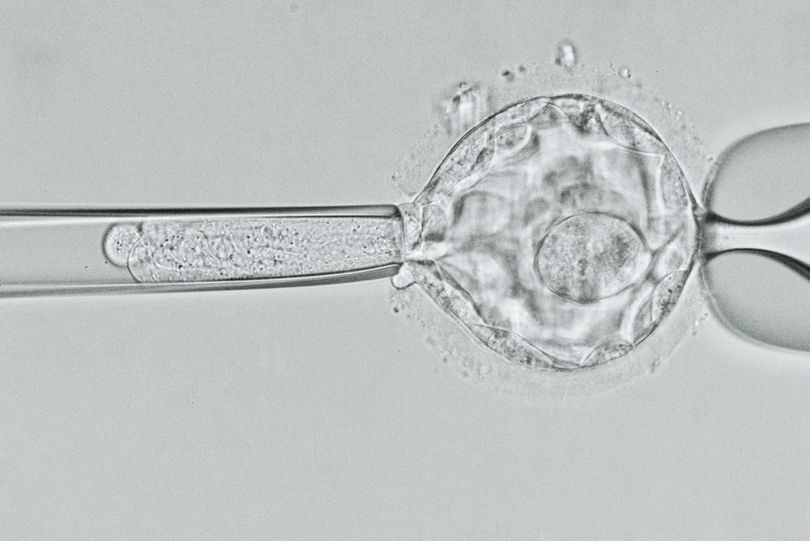
На заре применения метода рекомбинантных ДНК термины «трансгенный» и «генетически модифицированный» относились к организмам, созданным при комбинировании ДНК модифицируемого организма с фрагментами ДНК, взятыми у других видов. Возможно, CRISPR-технология поможет ученым переубедить обывателя: генная инженерия в ряде случаев не просто нужна — она необходима. Ведь эта технология позволяет менять геном определенного вида без участия инородного ДНК.
Яркий тому пример — золотой рис. Единственное отличие этого генетически модифицированного сорта риса от исходного вида заключается в том, что его зерна, как раз благодаря модификации, богаты витамином А. Ежегодно в развивающихся странах до полумиллиона детей теряет зрение из-за недостатка витамина А, но активисты, выступающие против ГМО, все равно заблокировали как исследования ученых, так и коммерческое производство золотого риса. Теперь же генетики поменяли тактику и начали работы по изменению свойств обыкновенного риса с помощью CRISPR, чтобы добиться того же результата за счет редактирования генов самого растения. А группе ученых во главе с Кайся Гао из Китайской академии наук удалось, удалив все три копии одного из генов пшеницы, вывести сорт растения, устойчивый к опасному грибковому заболеванию — мучнистой росе.
На протяжении тысячелетий агрономы перебирали — конечно, неосознанно — гены представителей того или иного вида, скрещивая разные сорта. CRISPR-технология, по сути, является более экономным методом селекции — высокоточным и ускоренным. В некоторых странах различия между ГМО-сортами и сортами, полученными благодаря CRISPR-технологии, уже официально подтверждены регулирующими органами — так поступили правительства Германии, Швеции и Аргентины.
Помимо грядущих изменений в пищевой промышленности трудно переоценить возможности CRISPR-метода в медицине. Технология уже существенно упростила исследования в онкологии — теперь ученым гораздо проще создавать экспериментальные клоны раковых клеток в лаборатории и тестировать на них различные лекарства, чтобы выявить наиболее эффективное в борьбе с развивающейся опухолью.
Очень скоро доктора опробуют метод CRISPR для непосредственного лечения некоторых заболеваний. Например, стволовые клетки людей, страдающих от гемофилии, можно будет отредактировать вне организма пациента, чтобы исправить мутантные гены, вызывающие данное заболевание.
Затем новые работоспособные клетки нужно будет ввести обратно в кровоток пациента.
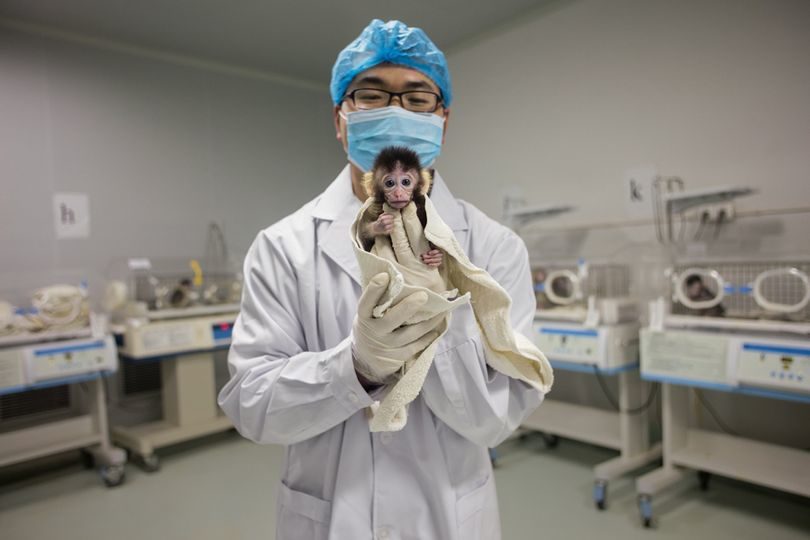
В ближайшие несколько лет нас ждут еще более удивительные научные прорывы. К примеру, в США около 120 тысяч человек записаны на трансплантацию органов, и очередь эта только растет. Тысячи людей умирают, так и не дождавшись спасительной операции. (И это без учета тех сотен тысяч людей, которые по разным медицинским показаниям не могут даже попасть в список на пересадку органов!) Долгие годы ученые пытаются решить проблему — в том числе и за счет использования органов животных. В числе кандидатов на донорство — свиньи, однако их ДНК содержит эндогенные свиные ретровирусы (PERV), похожие на ВИЧ и потенциально способные поражать клетки человека. Никакой государственный регулятор ни при каких условиях не разрешит пересадку зараженных органов, а до недавнего времени никому не удавалось полностью исключить ретровирусы из клеток свиньи. [Органы свиней используются в качестве потенциальных трансплантатов, поскольку они сопоставимы по размеру с человеческими и выращивать этих животных проще, чем шимпанзе и горилл (не говоря уже про этические проблемы), а отнюдь не потому, что они генетически ближе к людям, чем обезьяны. — ПРР.] Можно надеяться, что редактирование свиного генома с помощью CRISPR позволит генетикам обеспечить людей трансплантатами.
Группе под руководством Джорджа Черча, профессора Гарвардской медицинской школы и Массачусетского технологического института, уже удалось вырезать все 62 гена вирусов PERV из ДНК клетки свиной почки — сложнейшая операция с единовременным редактированием сразу нескольких участков генома проведена впервые. Когда модифицированные клетки смешали с человеческими в лаборатории, ни одна из клеток человека ничем не заразилась. Те же специалисты смогли успешно отредактировать и другие типы свиных клеток, удалив из них 20 генов, вызывающих отторжение чужеродных тканей иммунной системой человека. Это еще одна важная составляющая успешной трансплантации органов животных человеку.
Сейчас Джордж занимается клонированием модифицированных клеток, чтобы вырастить из них полноценные свиные эмбрионы. Через год-два он рассчитывает начать опыты на приматах, и, если после тестовых трансплантаций органы станут функционировать без сбоев, а отторжение не произойдет, то на следующем этапе можно будет ставить эксперименты с привлечением добровольцев. По оптимистичным прогнозам Черча подобные операции на людях станут реальны уже через полтора года, учитывая, что альтернатива риска для многих пациентов — неминуемая смерть.
На протяжении всей своей научной карьеры Джордж искал способ помочь людям, которым врачи отказали в трансплантации из-за низкой вероятности успеха. «Решение о пересадке органов для врачей одно из труднейших, — объясняет он. — Нужно учитывать множество факторов: наличие инфекционных заболеваний, злоупотребление алкоголем и вообще все, что «не так» с потенциальным реципиентом. Отказ принято подкреплять словами, что пересадка не принесет пациенту существенной пользы. Но это в корне неверно: безусловно, трансплантация дает второй шанс любому человеку! Просто нужно обеспечить достаточное количество донорских органов!»
Еще одно непаханое поле деятельности для CRISPR-технологии — восстановление популяций исчезающих видов. Скажем, популяции птиц на Гавайских островах стремительно сокращаются — всему виной особый вид малярийного плазмодия, поражающего пернатых. До того как в начале XIX века суда китобоев завезли на острова комаров, здешние птицы никогда не сталкивались c болезнями, переносчиками которых являются двукрылые, и не успели выработать к ним иммунитет. До наших дней дожили лишь 42 эндемичных гавайских вида, и три четверти из них уже находятся под угрозой исчезновения. Американская организация по сохранению птиц успела присвоить Гавайям статус «мировой столицы вымирающих видов пернатых». Если не остановить птичью малярию с помощью редактирования комариного генома, острова, скорее всего, лишатся всех собственных видов.
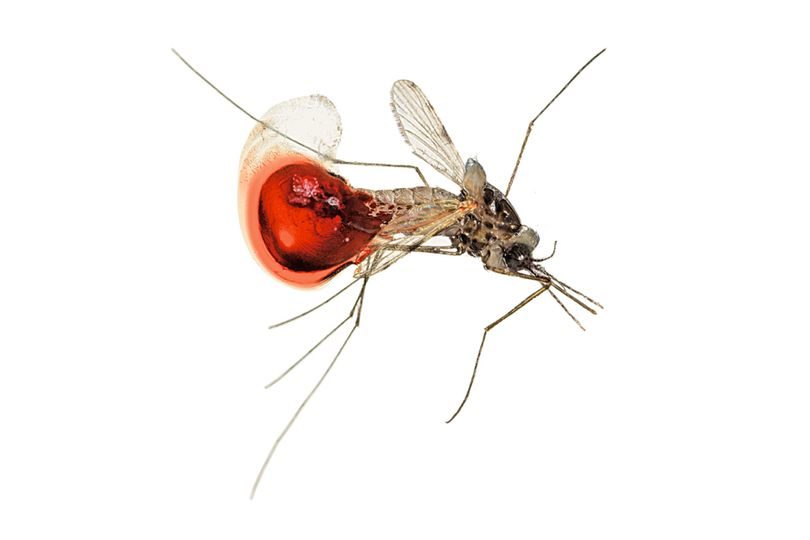
Джек Ньюман, в прошлом главный научный сотрудник компании Amyris, первой наладившей выпуск синтетического артемизинина — единственного эффективного лекарства для лечения малярии у человека, теперь сосредоточился на борьбе с птичьими болезнями, переносчиками которых являются комары. Единственный на сегодня относительно эффективный метод защиты птиц — полное устранение переносчиков, для чего требуется распылить отравляющие вещества на огромной площади. Относительный — потому что даже при таком подходе успех вовсе не гарантирован. «Чтобы комар погиб, инсектицид должен попасть прямо на него», — объясняет Ньюман. Но кровососы проводят большую часть жизни, скрываясь в кронах деревьев и прячась в углублениях скал или между камнями. Чтобы отравить основную часть популяции комаров, придется залить химикатами все Гавайские острова. Если же пойти по пути изменения генома и стерилизовать комаров, то птиц можно будет спасти и без уничтожения привычной им среды обитания. «Использование генной инженерии — невероятно точное решение сразу нескольких проблем Гавайев, — убежден Джек. — Птичья малярия неуклонно уничтожает экосистему островов, но у нас есть возможность остановить ее. Неужели мы просто будем сидеть сложа руки и смотреть, как природа гибнет на наших глазах?»
Правда, не все рады стремительному прогрессу. Так, в феврале 2016 года директор Национальной разведки США Джеймс Клеппер в ежегодном выступлении в Сенате предостерег: технологии генной инженерии вроде CRISPR могут использоваться для создания оружия массового поражения. Впрочем, научное сообщество тут же указало на безосновательность подобных заявлений, признав их чересчур радикальными. У террористов есть гораздо более легкие и дешевые способы для нападения на мирных граждан, чем заражение фермерских полей новой болезнью или разработка смертельно опасного вируса.
Не стоит, конечно, полностью исключать возможный вред от использования новых генных технологий. «Какие могут быть последствия опрометчивого обращения с геномом?» — задается вопросом Дженифер Даудна, профессор химии и молекулярной биологии Калифорнийского университета (Беркли).
В 2012 году Дженифер, совместно с коллегой Эммануэль Шарпентье из Института инфекционной биологии в Берлине (один из сети исследовательских институтов Макса Планка) впервые применившая CRISPR-технологию для редактирования ДНК, так отвечает на свой вопрос: «Я не думаю, что мы знаем достаточно о геноме человека, да и о геноме других животных, но люди все равно будут использовать эту технологию — и неважно, насколько хорошо она изучена».
Чем быстрее развивается наука, тем страшнее кажутся технологические угрозы, с которыми сталкивается человечество. Биология становится проще и доступнее, и в скором времени эксперименты с домашним набором CRISPR сможет проводить любой желающий — подобно радиолюбителям, собирающим у себя дома всевозможные приемники и передатчики. Так что обеспокоенность тем, что могут натворить любители в домашних лабораториях, если получат в руки инструмент для изменения фундаментальных основ генетики животных и растений, вполне оправдана.И все же не следует упускать удивительные возможности генной инженерии. Ведь если, например, удастся навсегда избавить человечество от малярии и других заболеваний, переносимых кровососами, это, безусловно, станет одним из величайших достижений современной науки. И хотя пока еще рано говорить о применении CRISPR-технологии для редактирования человеческих эмбрионов, есть другие способы преобразования генома половых клеток, позволяющие излечивать болезни, при этом не затрагивая ДНК будущих поколений.
Скажем, у детей с болезнью Тея-Сакса отсутствуют ферменты, необходимые для расщепления ганглиозид — жирных кислот, накапливающихся в нервных клетках головного мозга, что ведет к отмиранию этих клеток и, как следствие, к торможению умственного и физического развития, а затем и к ранней смерти ребенка. Заболевание встречается крайне редко и только в тех случаях, когда оба родителя передают своим детям дефектную копию одного и того же гена (что характерно для замкнутых людских групп с близкородственным скрещиванием). С помощью CRISPR-технологии можно скорректировать генетический материал одного из родителей — например, сперматозоиды отца — и ребенок наверняка не унаследует сразу обе дефектные копии.
В будущем подобная генная терапия сможет спасать жизни и снижать вероятность заболевания. Схожего эффекта уже можно добиться — при искусственном оплодотворении: выбор эмбриона без дефектной копии гена гарантирует, что новорожденный не передаст заболевание по наследству своим потомкам.
«Технологии переноса генов и метод CRISPR предоставляют нам широчайшие возможности, о которых раньше никто не мог и мечтать, — подытоживает Хэнк Грили, директор Центра права и биологических наук при Стэнфордской медицинской школе. — С их помощью мы способны сделать много хорошего. Но важно осознавать: мы обрели власть совершенно иного порядка, и необходимо убедиться, что мы распорядимся ею разумно. Пока мы не готовы взять на себя такую ответственность, но нельзя терять ни дня — предстоит очень много сделать, чтобы гарантировать себе спокойную жизнь в будущем».
Источник http://www.nat-geo.ru/


