Миодистрофия Дюшенна (МДД) – прогрессирующее мышечное дегенеративное заболевание, одно из самых распространенных смертельных генетических заболеваний (распространенность 1:3500 мальчиков). МДД проявляется прогрессирующей дистрофией проксимальных мышц, псевдогипертрофией голеней, снижением функциональности дыхательных мышц и миокарда, в 30% случаев возможна задержка умственного развития, дебют заболевания приходится, как правило на возраст 2-5 лет, потеря способности самостоятельно передвигаться в среднем в 7-13 лет, пациенты погибают в возрасте 20-25 лет от сердечной и/или легочной недостаточности [1, 2].
В основе патоморфогенеза заболевания лежит цепь «ген-белок-функция-болезнь», повреждения в гене DMD вызваны точечными мутациями, делециями и дупликациями, что является причиной сдвига рамки считывания (последовательности нуклеотидов в составе ДНК или РНК, потенциально способной кодировать белок) и потерей функционального дистрофина. Дистрофин – крупный белок в структуре которого имеются 4 основных домена, необходимых для функционирования. Остальные участки белка не имеют критического значения, таким образом отсутствие одного из них не приводит к нарушению функциональности, либо клинически проявляется в более мягкой форме (миопатия Беккера). Эти особенности дистрофина позволили рассматривать метод пропуска экзона с целью восстановления рамки считывания как наиболее оптимальный подход к лечению заболевания.
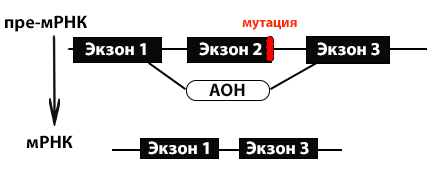
Был проведен большой пул как доклинических, так и клинических исследований с использованием антисмысловых олигонуклеотидов, молекул способных «закрыть» определенные участки пре-мРНК для их дальнейшего исключения из процесса транскрипции и синтеза белка (рис. 1), но эффективность этих конструкций при введении пациентам до сих пор остается не доказанной.
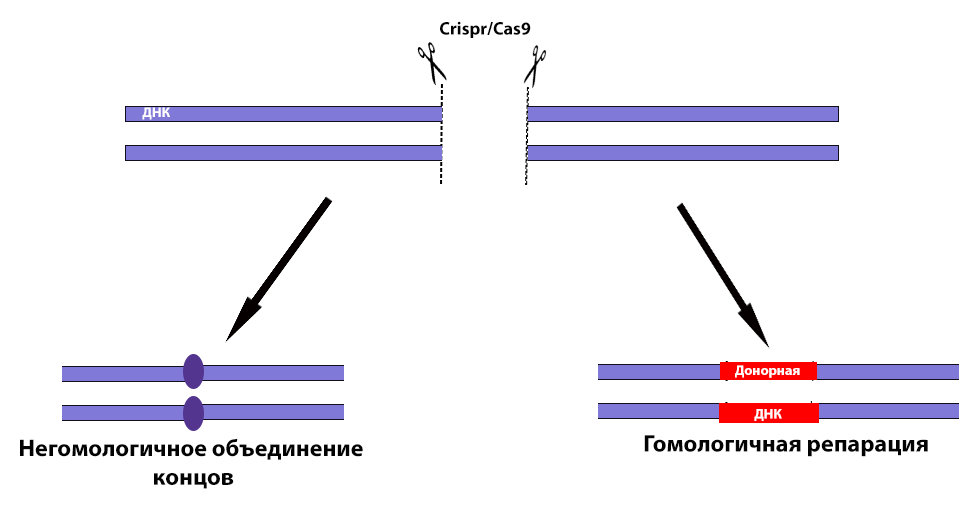
Поэтому поиск эффективной геннотерапевтической конструкции по-прежнему остается актуальной задачей. Как один из новых подходов рассматривается технология CRISPR/Cas9, которая позволяет точечно корректировать вызывающие заболевания мутации. В присутствии гидовой РНК (РНК, комплементарная участку ДНК, за которым будет следовать разрез), эндонуклеаза Cas9 осуществляет двухцепочечный разрыв ДНК. Если в клетку введен участок донорной ДНК, содержащий последовательность, которой необходимо заменить удаленный набор нуклеотидов, то происходит гомологичная репарация – восстановление целостности ДНК с участием донорного участка, то есть закрытие дефекта генетической «заплаткой». Без добавления экзогенного участка целостность молекулы ДНК восстанавливается с помощью процесса, называющегося негомологичное объединение концов, когда два конца «сшиваются» друг с другом с помощью достройки либо удаления необходимых фрагментов под действием ряда ферментов, таким образом можно исключить мутантный экзон из ДНК (рис. 2).
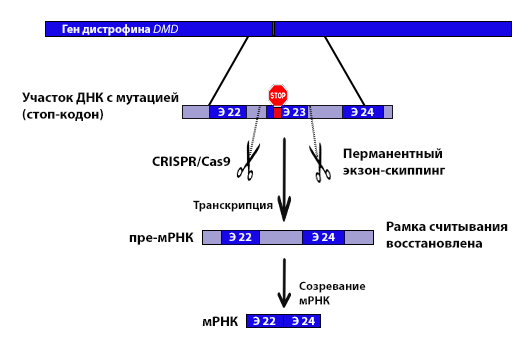
Гомологичная репарация практически не происходит в постмитотических клетках, к которым относятся и клетки мышечной ткани, поэтому замена донорским участком невозможна. Но с помощью CRISPR/Cas9, опосредованного негомологичным объединением концов, которое C. Long с соавт. обозначили как «миоредактирование», можно удалить из ДНК сразу несколько участков, в которых наиболее часто встречаются мутации (рис. 3), что позволяет охватить наиболее широкий спектр пациентов (62% пациентов с МДД имеют мутации в экзонах 45-55, их удаление не приводит к прекращению синтеза дистрофина). Таким образом, этот подход аналогичен экзон-скиппингу, осуществляемому с помощью антисмысловых олигонуклеотидов, но является универсальным [3].
Первое практическое применение этой технологии было описано сразу в трех научных работах. C.E. Nelson с коллегами провел ряд экспериментов на mdx (дистрофин-дефицитных) мышах с нонсенс мутацией в экзоне 23, которая приводила к преждевременному прекращению синтеза дистрофина. В переднюю большеберцовую мышцу была введена система на основе двух векторов – аденоассоциированных вирусов, серотип 8 (ААВ8). Вектор 1 содержал две гРНК, таргетированные к интронам 22 и 23, вектор 2 – ДНК, кодирующую Cas9. Мышечная ткань была проанализирована через 8 недель. Цифровая капельная ПЦР показала исключение экзона 23 из 59% транскриптов (молекул РНК соответствующих гену DMD), по данным иммуногистохимического анализа 67% мышечных волокон синтезировали дистрофин. При этом достаточно только 4% от нормального уровня дистрофина для улучшения функции мышц и 30% для асимптоматического течения заболевания. Гистологическое исследование показало снижение макрофагальной инфильтрации, уменьшение воспаления, характерного для дистрофии, не было выявлено очевидной токсической реакции на воздействие вектора, либо трансгена. Увеличение тетанической силы и силы одиночного сокращения подтвердило улучшение функционального состояния ткани.
При интраперитониальном введении системы геномного редактирования двухдневным мышам было показано восстановление экспрессии дистрофина в абдоминальной мускулатуре, диафрагме и сердце на 7 неделю после инъекции. Важно отметить, что ослабление именно этих мышц приводит к ранней смерти от дыхательной и сердечной недостаточности. Также, в результате введения векторов шестинедельным взрослым mdx мышам был значительно восстановлен дистрофин в сердечных мышцах. Эффект от проведенного лечения сохранялся на протяжении минимум 6 месяцев [4].
В работе научной группы M. Tabebordbar произведено удаление экзона 23 посредством интраперитониального введения ААВ9 с CRISPR/Cas9 трехдневным мышам. Восстановление дистрофина проанализировано через 4 недели, уровень исследуемого белка составил 3-18% по сравнению с контрольной группой в различных мышцах. Через 3 недели после введения в переднюю большеберцовую мышцу, как и в предыдущем исследовании, было установлено восстановление дистрофина и улучшение функциональности мышц [5].
Научной группой C. Long произведено сравнение трех способов введения редактирующих конструкций с помощью ААВ9: внутримышечно (в/м), ретро-орбитально (р/о) – в качестве альтернативы введению в хвостовую вену для системного распределения – и интраперитониально (и/п). Через 3 недели после в/м введения количество дистрофин-положительных волокон составило 7,7±3,1% от общего примерного числа волокон, а через 6 недель увеличилось до 25,5±2,9%. Гистологический анализ с окрашиванием гематоксилином и эозином показал отсутствие некротизированных мышечных волокон и значительное снижение воспалительной инфильтрации. CRISPR/Cas9, введенные р/о, через 4 недели восстановили дистрофин в 2,5 ± 1,1% поперечнополосатой мускулатуры и 1,1 ± 0,3% кардиомиоцитов, спустя еще 8 недель их количество выросло до 4,6 ± 3,2% и 9,6 ± 3,9%, соответственно. Максимальные цифры через 8 недель после и/п введения составили 1,8 ± 1,2% и 3,2 ± 2,4% для поперечнополосатой мускулатуры и кардиомиоцитов, соответственно. По данным иммуногистохимического анализа, уровень дистрофина в передней большеберцовой мышце составил: при и/п введении 23,7 ± 11,6% от контрольной группы, р/о – 27,7 ± 6,6% и в/м – 53,2 ± 18,5%. Уровень дистрофина в кардиомиоцитах: и/п – 52,4 ± 14.3%, р/о – 71,1 ± 21.0%, в/м – 69,7 ± 19,8%.
Несмотря на то, что в этом исследовании не было выявлено нецелевых мутаций в 10 вероятных сайтах, спрогнозированных in silico, мутации могут появляться в других областях. Кроме этого, C.E. Nelson с соавт. указывают на наличие ~3% indel-мутаций (вставки/делеции) в 10 спрогнозированных нецелевых сайтах, по данным глубокого секвенирования РНК. Следовательно, при дальнейшей работе в этом направлении полногеномное секвенирование после удаления участков ДНК должно стать неотъемлемой частью исследований [3].
В каждом из экспериментов продемонстрировано увеличение синтеза нормального дистрофина до значений, которые позволят значительно смягчить клиническую картину и избежать серьезных сердечно-легочных осложнений. Рассмотрена возможность использования двух серотипов ААВ в качестве вектора, а также различные способы введения, как локально для взрослых организмов с заболеванием на поздней стадии, так и системно в постнатальном периоде. Таким образом, миоредактирование – универсальный эффективный метод, с помощью которого можно произвести стойкое восстановление дистрофина в пост-митотических взрослых тканях на различных этапах развития организма и болезни.
Описанные работы являются первым опытом применения технологии CRISPR/Cas9 для терапии МДД, а также единственным, на сегодняшний день, примером перманентного экзон-скиппинга в области генной терапии. Данная технология, вероятно, найдет применение и в разработке методов терапии других заболеваний, где допустим пропуск экзона и укорочение белка. Но несмотря на то, что успешная отработка этого подхода – важный шаг в поиске средств лечения тяжелого и смертельного заболевания, миоредактирование нуждается в дальнейших исследованиях с особым акцентом на безопасность применения, как самостоятельное средство восстановления мышечной функции у пациентов с МДД, так и в сочетании с другими терапевтическими подходами.