Прошло всего три года с тех пор, как биологи научились редактировать геномы новым инструментом — молекулярной системой CRISPR/Cas9. Технология оказалась настолько лучше предыдущих, что уже сейчас встал вопрос о модификации эмбрионов человека и лечении генетических болезней.
14 апреля в журнале Protein & Cell появилась статья китайских генетиков из Гуанчжоу под названием «Редактирование генов посредством CRISPR/Cas9 в триплоидных зиготах человека». Эту публикацию ждали с нетерпением и страхом, ей предшествовала бурная дискуссия в журнале Nature. Говорили, что нужно запретить подобные исследования на ближайшее время, хотя детали работы китайцев ещё даже не были известны. Однако научное сообщество было в курсе, что эксперименты шли с человеческими эмбрионами. Все понимали, что это была первая в истории попытка генетически модифицировать человека.

И вот статья вышла. Учёные вздохнули с некоторым облегчением, поскольку попытка удалась лишь частично и эксперимент прекратили на ранней стадии.
Итак, что же сделала группа под руководством Цзюньцзю Хуана из Университета Сунь Ятсена? Если коротко: попыталась вылечить генетическое заболевание бета-талассемию на уровне эмбриона. То есть исправить генетику человека.
48 часов длился эксперимент по редактированию генома человека. Его прервали на стадии восьмиклеточных эмбрионов.
Бета-талассемия — болезнь крови, которую вызывает мутация в одном из генов гемоглобина. С такой болезнью человек живёт всю жизнь и может передать мутантный ген по наследству. Учёные попробовали заменить испорченный ген на здоровый и таким образом продемонстрировать: болезнь можно вылечить, отредактировав геном.
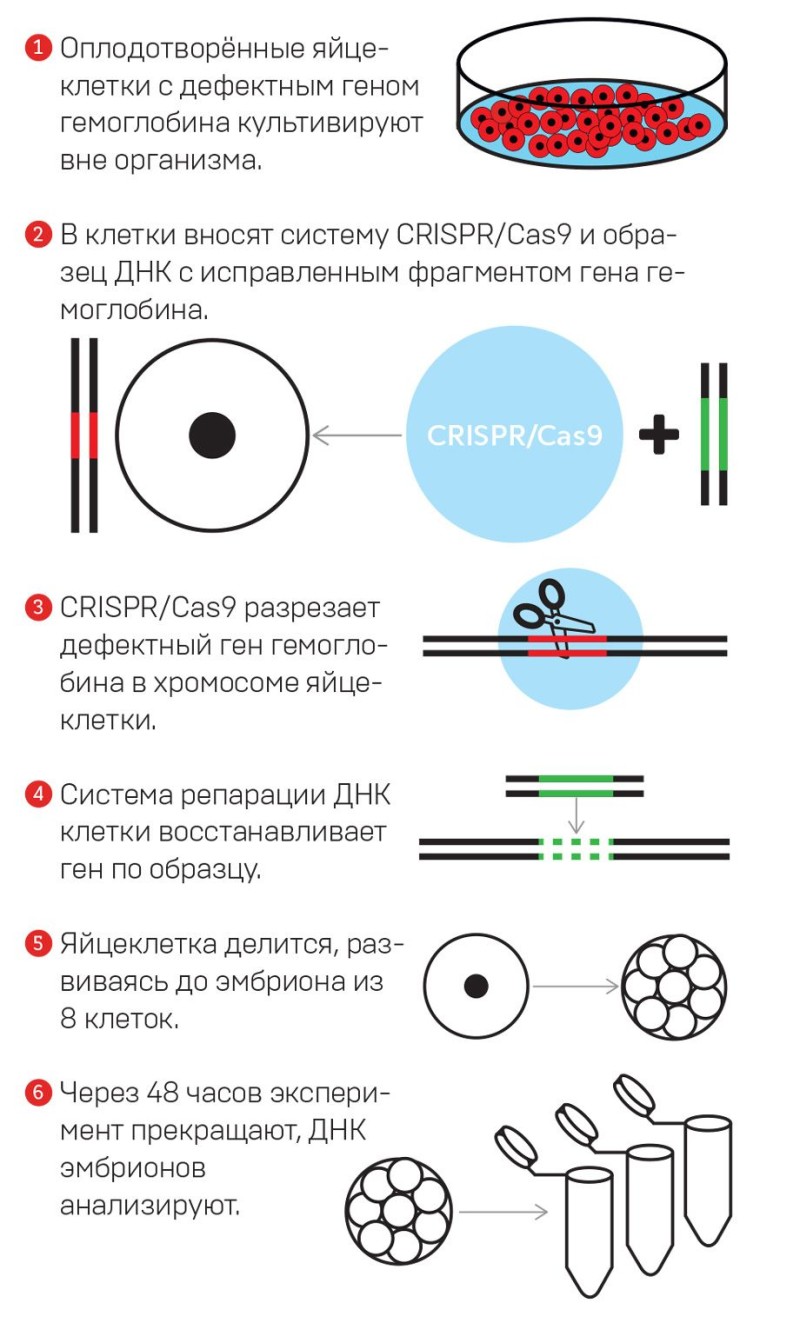
Для эксперимента взяли 86 оплодотворённых яйцеклеток, причём оплодотворённых необычно — сразу двумя сперматозоидами. Каждая яйцеклетка в результате имела не два набора хромосом, как у всех нас, а три — один от матери и два от отца. При искусственном оплодотворении такое случается примерно в 2–5% случаев. Эти эмбрионы не выживают, но некоторое время могут развиваться в пробирке. «Достаточное для целей эксперимента», — написали исследователи. Мутантный ген находился в хромосомах матери, исправить предстояло его.
Внутрь яйцеклеток внесли фрагмент «здорового» гена гемоглобина, а также молекулярную систему CRISPR/Cas9, которая должна была обеспечить «редактирование», то есть изменение мутантного гена в хромосоме на «здоровый».
Из бактериального оружия против вирусов учёные создали инструмент для изменения геномов. В том числе человеческих.
Потом ждали 48 часов, пока яйцеклетки делились. Когда эмбрионы состояли из 8 клеток, посмотрели, что получилось. Результат несколько обескуражил: только 4 эмбриона из 86 оказались правильно отредактированными, то есть содержали исправленный ген гемоглобина. Но всё же 4 получили!
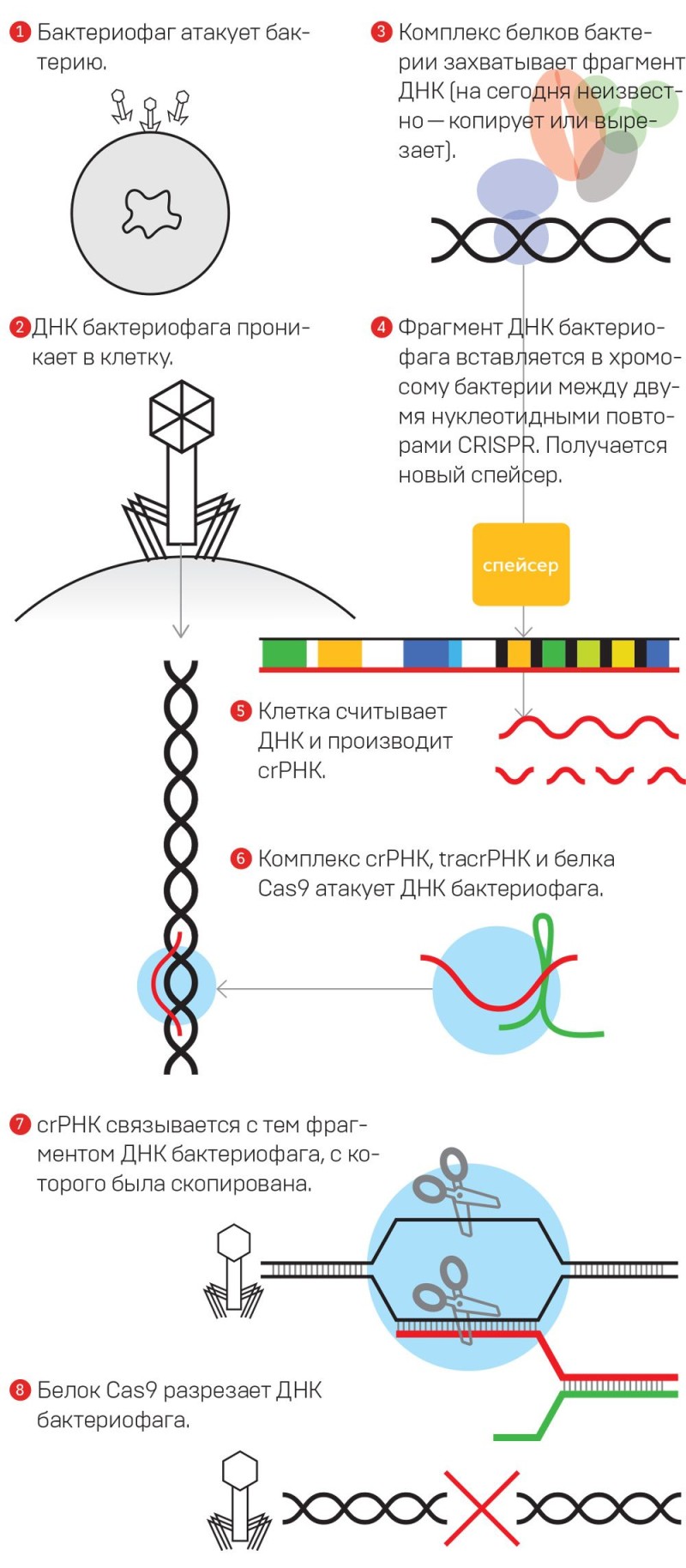
Звучит всё это сложно для ушей человека, далёкого от молекулярной генетики, но на самом деле опыт довольно простой — при надлежащем оборудовании и материалах его может поставить студент-второкурсник. Да и оборудование не адронный коллайдер, прямо скажем. Дело здесь как раз в простоте и эффективности системы, которая умеет редактировать геномы — CRISPR/Cas9 (генетики произносят «криспер»). Эта система в природе есть у прокариот: бактерий и архей. Это их оружие против паразитов: вирусов и плазмид.
Гонка вооружений
— Система CRISPR/Cas9 состоит из двух частей, — говорит Евгений Кунин, сотрудник Национального центра биотехнологической информации США. — Одна часть — это адаптивный модуль, который занимается тем, что выбирает из чужеродной ДНК вируса фрагменты и вставляет их во вполне определённое место в геноме бактерии или археи. Вторую часть можно назвать операционной. Она обрабатывает эти уникальные вставки, делает из них короткую РНК и с её помощью атакует исходную, чужеродную ДНК. Инактивирует вирус или плазмиду.
Евгений Кунин
Эксперт в области вычислительной и эволюционной биологии, один из ключевых исследователей системы CRISPR.
Обладатель самого большого индекса Хирша среди всех русскоязычных учёных — 136. Сотрудник Национального центра биотехнологической информации США.
То есть бактерия использует кусочки ДНК, чтобы находить проникший в неё вирус. «Наводчиком» служит так называемая РНК-гид, которая построена на основе этих кусочков. Она как бы сравнивает последовательности нуклеотидов: «Оно? Нет, не оно, пусть живёт. Ага, а вот это паразит, будем резать!» И белок Cas9 режет в этом самом месте вирусную ДНК на части, спасая бактерию от инфекции и гибели.
Евгений Кунин считает, что в процессе эволюции сначала возникла вторая часть системы, «боевая» — белок Cas9.
— Теперь адаптивный модуль, — продолжает Кунин. — Те гены, которые его составляют, — родственники генов, находящихся в транспозонах, подвижных генетических элементах. Транспозоны имеют интересный образ жизни. Они прыгают по геному — это такие молекулярные паразиты. А их гены кодируют фермент для прыжков: вырезать ДНК из одного места, вставить в другое. И вот это свойство взяли на вооружение сами бактерии. Получился такой одомашненный транспозон, который сам уже не может прыгать, зато может вставлять внутрь себя чужую ДНК.
Это очень интересно, потому что таким же образом эволюционировала адаптивная иммунная система и у животных. Но и сама эта система — инструмент эволюции генома. Когда она функционирует, геном всё время меняется, в него вставляются всё новые куски ДНК в ответ на вирусы и прочую чужеродную ДНК, приходящую из окружающей среды. Это, нравится кому или нет, в чистом виде ламарковские принципы. Пожалуй, наиболее яркий, хотя и не единственный пример такого рода эволюции.
Вся эволюция — это непрерывная гонка вооружений, борьба и одновременно эволюция паразитов с хозяином. И криспер — одна из самых сложных систем, участвующих во взаимодействии архей и бактерий с паразитами, в первую очередь вирусами.
Из бактериального оружия против вирусов учёные создали инструмент для изменения геномов. В том числе человеческих. И сделали это совсем недавно, около трёх лет назад. Суть в том, чтобы вместо РНК-гида, которая наводит «криспер» на место разреза в бактериальном вирусе, использовать РНК, которая покажет ферментам, в каком месте нужно резать хромосому в клетке организма, в которых CRISPR/Cas9 системы никогда не было, например, в клетках в растений, животных, человека… Таким образом можно разрезать ДНК почти в любом месте генома. Все зависит от того, какую РНК-гид вы введете в клетку, а синтезировать РНК научились уже очень давно. Так что технология действительно проста и точна.
Механизм работы системы CRISPR — иммунной системы клетки
(CRISPR — Clustered Regularly Interspaced Short Palindromic Repeats, что значит короткие палиндромные повторы, регулярно расположенные группами)
Заменить ген в организме
Бактериальная система уничтожает паразитов, режет их на куски. Но для редактирования генома животных, растений и человека этого мало. Нужно ведь заменить один ген на другой, а не просто уничтожить часть хромосомы. И здесь на помощь приходят собственные системы клеток. Есть такой процесс — репарация ДНК. Специальные ферменты «видят» разрыв в цепи ДНК и буквально «заштопывают» его.
Но откуда клетка знает, как штопать? Какими «нитками» и какими «стежками»? Ведь ей нужно понять, что было на месте разрыва. Вот для этого у нас в клетках два набора хромосом с аналогичным набором генов — один от папы, один от мамы. Они чуть отличаются, но всё же это одни и те же гены. Ферменты берут за образец целый ген с другой хромосомы и по этому образцу заполняют разрыв.
Это свойство клеток и использовали генетики. Кроме того, можно внести в клетку искусственно созданную «правильную» копию гена, и тогда ферменты могут взять за образец её. Собственно, китайские учёные так и делали в своих экспериментах — разрезали испорченный ген и вносили ДНК здорового гена. Остальное клетка делала сама.
Задуманное удалось лишь частично. Всего 4 эмбриона из 86. В остальных система либо не нашла испорченный ген, либо не вставила на его место здоровый. К тому же оказалось, что CRISPR/Cas9 ещё и сделала много ошибок — резала ДНК не в тех местах, где нужно. Понятно, что с такой эффективностью до управления геномом человека ещё далеко. Ни одна будущая мама не согласится на такую рулетку.
Константин Северинов
Молекулярный биолог, специалист в области регуляции экспрессии генов, экологии бактерий, взаимодействия бактерий и вирусов.
Профессор Университета Ратгерса (США) и Сколковского института науки и технологий.
— Эта система в клетках прокариот предназначена для того, чтобы раскусить двойную цепь ДНК в определённом месте. А генетики используют её, чтобы вносить «раскусы» в ДНК высших организмов. В частности, в человеческих клетках, — говорит Константин Северинов, профессор Университета Ратгерса (США) и Сколковского Института Науки и Технологий. — Конкретно те системы, которые применяются, узнают участки ДНК длиной 20–25 нуклеотидов. Некоторые последовательности такой длины в человеческом геноме уникальны. Поэтому можно ожидать, что Cas9-белок с большой вероятностью попадёт точно в цель и внесёт единичный «раскус» именно там, где запрограммировано РНК-гидом.
Но в клеточной ДНК всегда найдется некоторое количество последовательностей, которые отличаются от мишени, полностью соответствующей разработанной исследователем РНК-гиду на одну букву (на один нуклеотид — КШ.). Взаимодействие с каждой из такой мишеней менее прочно чем с настоящей. Но, тем не менее, его достаточно, чтобы с какой-то частотой вносить раскусы и туда. А если мы рассмотрим варианты, где у нас две буквы отличаются, три… Их будет великое множество и в каждую из таких «неидеальных» мишеней CRISPR/Cas9 система может с какой то вероятностью узнать и раскусить.
Можно ли улучшить точность действия системы, или мы должны поставить крест на генетических модификациях человека? Ведь одно дело с помощью CRISPR/Cas9 создать новую породу животных, сорт растений, штамм бактерий, даже изменить стволовые клетки человека, и совсем другое — работать с человеческим эмбрионом. Во всех случаях, кроме последнего, стопроцентная эффективность не нужна — можно потом из множества экспериментов выбрать удачный. Но с эмбрионом человека так нельзя: для конкретных родителей он существует в одном-единственном экземпляре.
В 4 из 86 образцов произошла замена дефектного гена на исправленный.
— Технически систему доработать можно, — говорит Северинов. — Нет никаких причин, по которым нельзя перебрать какое угодно количество эмбриональных клеток и найти ту, в которой произошло только требуемое событие редактирования, а неправильные, неспецифические события не произошли. До определенной стадии из развивающегося эмбриона можно без особых последствий взять некоторое количество клеток. Близнецы возникают именно таким образом: на определённой ранней стадии эмбрион просто делится на две части и получаются два эмбриона. Соответственно, так же можно брать клетки без ущерба для эмбриона и проверять, как произошло редактирование. Я уж не говорю о том, что можно вообще не использовать оплодотворенные яйцеклетки, а использовать для редактирования стволовые клетки. Их просто размножать в культуре, а потом взять часть клеток и проверить, отредактировали ли вы их ДНК там, где надо, или ещё где-то. И если редактирование произошло в не нужном месте, просто прекратить опыт.
Эксперимент по редактированию гена бета-талассемии в эмбрионе человека
Эксперимент проводился в культуре клеток
Запретить или разрешить
Разговоры о том, что работу с репродуктивными клетками нужно отложить до лучших времён, ввести временный запрет, пошли ещё до публикации китайских учёных. Технология развивается взрывоподобно, эксперименты с мышиными эмбрионами провели давно, а в 2014-м в том же Китае генетически модифицировали макак. Две обезьянки от одной матери родились в прошлом январе. У обеих изменено по два гена: регулятор метаболизма и ген иммунной системы. У родителей они были другими. Надо сказать, приматов генетически модифицировали и раньше — теми методами генной инженерии, которые использовались до CRISPR/Cas9. Но предыдущие технологии не позволяли точно попасть в нужный ген.
После успеха с обезьянами стало ясно, что на очереди человек. Но научное сообщество оказалось не очень-то готово к такой ответственности: мы ведь до сих пор плохо представляем, как скажется изменение даже одного, даже не очень здорового гена на всей остальной биохимической машине клетки и в конце концов на организме. Другой вопрос: что будет с популяцией человека в целом, если мы начнём активно манипулировать собственной генетикой? Так и во что-то нечеловеческое превратиться можно.
Ещё одна проблема: нет регулирующего законодательства. Во многих странах работы с эмбрионами запрещены, во многих — не поощряются. (Кстати, в США, ведущей генетической державе мира, запрещено давать государственные гранты на такие работы, но ими можно заниматься в частном порядке.) Но специальных законов пока нет. Более того, есть пример из другой области: в Великобритании принят закон о том, что при искусственном оплодотворении можно не просто взять сперму отца и яйцеклетку матери, а ещё и пересадить в яйцеклетку митохондрии от донора. Закон вступает в силу в октябре. Риск развития болезней, связанных с митохондриальными генами, есть примерно у одного человека из шести с половиной тысяч, поэтому можно не сомневаться, что вскоре появятся дети от трёх родителей: матери, отца и донора митохондрий. Подобный законопроект рассматривается и в США. Это означает, что генетические манипуляции с потомством уже начались.
Дженнифер Дудна
Профессор Калифорнийского университета в Беркли. Совместно с Эммануэль Шарпантье является главным автором технологии CRISPR/Cas9.
Они и ещё несколько учёных в 2012 гоуд опубликовали первую статью по её применению.
Закономерно, что более всего озаботились регулированием авторы метода CRISPR/Cas9. В январе одна из его основоположниц, американка Дженнифер Дудна, собрала в Калифорнии авторитетных генетиков, чтобы обсудить ситуацию. Позвали даже ветерана молекулярной биологии Пола Берга, нобелевского лауреата и организатора знаменитой Асиломарской конференции 1975 года. По результатам той конференции были приняты правила работы в генной инженерии, введён ряд запретов и мораториев. Сейчас учёные хотят проделать нечто подобное. В меморандуме, опубликованном в журнале Science 3 апреля, они рекомендуют запретить клинические эксперименты по генетической модификации человека до тех пор, пока не будут ясны последствия и введены правила.
— Я довольно хорошо знаю тех, кто писал эти письма, начиная с Пола Берга… Его, очевидно, пригласили, чтобы создать ощущение преемственности, как создателя генной инженерии и организатора Асиломара. Кроме обсуждения реальных проблем и вопросов, это в значительной степени и PR акция. Во времена Асиломара биотехнологии, как промышленности, не существовало, а сейчас в этой области крутятся огромные деньги, и использование CRISPR/Cas9 технологий сулит очевидные выгоды, в частности их создателям, которые наверняка получат Нобелевскую премию, — говорит Константин Северинов. — Но по сути предлагать какие-либо запреты бессмысленно. Так же, как это оказалось бессмысленно в случае с Асиломаром. Тогда довольно скоро выяснилось, что волнения по поводу клонирования ДНК и создания генноинженерных организмов несостоятельны. С другой стороны, те, кто хотел заниматься применением генной инженерии к развитию бактериального оружия, все равно им занялись, несмотря на всё регулирование. И в СССР, и в США.
То же самое с эмбриональными стволовыми клетками: в результате запретов, которые были во времена президент Буша, пострадала американская наука. Но тогда Китай не был научной сверхдержавой, а сейчас в Китае всё настолько хорошо развито, что любой запрет в США или Европе ни к чему не приведет, движение продолжится и без них… Это соображение не относится к данной работе, так как в ней собственно научного результата в общем-то нет. Редактирование делали на клетках человека и раньше, животных, отредактированных с помощью CRISPR/Cas9 технологий, также уже получали, так что желание попробовать на человеческих эмбрионах естественно, это был просто вопрос времени …
Понимаете, технология CRISPR настолько простая, что непонятно, как можно было бы остановить такие работы, исключая введение уголовной ответственности. Люди всё равно будут это делать. Лучше, чтобы они это делали открыто, при условии соблюдения законодательства.
Призрак евгеники
Конечно, все участники этой истории держат в уме и этические проблемы. Можно ли не просто лечить генетические болезни, а создавать людей с определёнными признаками? Более умных, более красивых, сильных? Всплывает призрак евгеники — учения об улучшении человеческой породы, когда-то провозглашённого двоюродным братом Дарвина Фрэнсисом Гальтоном, а затем надолго скомпрометированного расовыми чистками в нацистской Германии.
Фрэнсис Гальтон
Английский географ, антрополог и психолог, автор многих методов в этих областях.
Автор термина «евгеника» и ряда исследований по возможностям улучшения человеческой природы.
— Я не подпишусь под утверждением, что этических проблем нет, хотя считаю их преувеличенными, — говорит Северинов. — Этическая проблема возникает, например, на следующей стадии: вот у вас есть оплодотворённая яйцеклетка, полученная в клинике по искусственному оплодотворению, или растущий в пробирке ранний эмбрион. Они невостребованы и хранятся в холодильнике. Такого материала очень много, его часто просто выбрасывают. Но если вы начинаете этим материалом манипулировать, изменять его ДНК, а затем, допустим, использовать его для подсадки и вынашивания матерью и получения человека, то следует задуматься, что, вообще говоря, из таких клеток — без модификации — могло возникнуть что-то другое (или кто-то другой!). Ведь если вы верите в бессмертную душу, то встаёт вопрос, когда она возникает и что является её основой. Если набор генов определяет то, что мы есть, то изменение генов способно изменить нас, нашу сущность.
Редактирование генома позволяет папам и мамам влиять на то, какими вы будете. А вас никто не спрашивает, вы ведь просто ещё не существуете.
Но и без бессмертной души есть вопросы. Сам факт вашего создания был результатом случайной комбинации генов папы и мамы, который они никак не могли контролировать. Но в принципе редактирование генома позволяет папам и мамам влиять на то, какими вы будете. Причём они не обязательно могут захотеть вас лечить от какой-нибудь реальной или мнимой болезни. Допустим, родители хотят только лучшего. И принимают решения, которые будут влиять на всю вашу жизнь. А вас о них никто не спрашивает, вы ведь просто еще не существуете в момент принятия этих решений. Они могут быть разумными на том уровне, на котором в данный момент находится наука, а потом может оказаться, что это не так.
Что же про евгенику… Мы не знаем, какие генетические варианты определяют человеческие свойства. За исключением очень небольшого набора простых болезней. Поэтому я не вижу даже в перспективе, что можно будет менять те признаки, которые хотелось бы. Интеллект, например, улучшать. У нас нет для этого знаний, мы просто не понимаем генетической основы сложных человеческих признаков. На самом деле нет даже уверенности, что у всех признаков есть генетическая подоплека. Но к самой идее я отношусь спокойно: если бы кто-то захотел сделать это и смог, пусть пробует.
Есть, впрочем, одно обстоятельство, которое может подтолкнуть применение генетических модификаций детей. После расшифровки генома человека накапливаются данные о генах предрасположенности к различным болезням. Пока это на уровне «если у вас такой-то аллель гена, то вероятность заболеть болезнью Альцгеймера повышается в пять раз». Конечно, для отдельного человека это мало что значит: была вероятность, допустим, одна стотысячная, а стала одна двадцатитысячная. Или значит?
Битва за патенты
Когда мы готовили эту публикацию, мы настойчиво пытались связаться и с авторами работы из Китая, и с Дженнифер Дудна, возглавившей борьбу за мораторий, и с наиболее крупными фирмами, ведущими медицинские разработки на основе CRISPR/Cas9. Вежливым отказом от интервью ответила лишь Дженнифер, сославшись на занятость. Остальные просто отмолчались.
$89 млн. Столько вложено в стартап фирмы CRISPR Therapeutics, разрабатывающей медицинские приложения системы CRISPR/Cas9.
Понятно, почему не дают комментарии китайские учёные: сейчас они под серьёзным давлением. По вполне убедительным слухам, от публикации их результатов отказались оба ведущих журнала, Science и Nature, — именно по этическим соображениям. Несмотря на то что работа сделана предельно корректно, даже эмбрионы взяты заведомо нежизнеспособные, триплоидные (кстати, возможно, именно это послужило причиной такого низкого выхода отредактированных геномов). В конце концов статья вышла в Protein & Cell.
А вот западные исследователи несколько удивили — обычно они охотно идут на контакт с прессой. Вполне вероятно, причина в том, что сейчас начинается судебная тяжба за приоритет и патенты. История вот в чём.
Есть три серьёзные компании, которые своей целью заявляют медицинские приложения CRISPR/Cas9: американские Editas Medicine и Intellia Therapeutics, а также CRISPR Therapeutics со штаб-квартирами в Швейцарии, Великобритании и США. Всё пока в состоянии стартапов, но даже на этой стадии бюджеты впечатляют: $43 млн, $15 млн, $89 млн. И это не предел, потому что инвесторы — биофармацевтические компании с миллиардными капиталами — готовы вкладывать больше. Например, в конце апреля CRISPR Therapeutics получила $64 млн.
Самое интересное, что соучредители всех трёх компаний — учёные, которые внесли наибольший вклад в изобретение технологии. Расстановка сил следующая. Дженнифер Дудна — Intellia Therapeutics. Эммануэль Карпентер, соавтор Дженнифер по самой первой работе 2012 года, — CRISPR Therapeutics. Фен Чжан (Feng Zhang) и Джордж Чёрч, первыми опубликовавшие результаты редактирования клеток эукариот и человека, — Editas Medicine.
Соучредителем последней компании была и Дудна, но произошло непредвиденное: в прошлом году Фен Чжан оформил фактически на себя и свой институт патент по работе с эукариотическими клетками. То есть и с клетками человека тоже. Любое коммерческое использование системы теперь должно идти через получение лицензии у него. После этого Дудна порвала с Editas Medicine и теперь судится с Чжаном за приоритет. В ходе тяжбы на свет извлекаются лабораторные журналы с записями экспериментов. На кону миллиардные инвестиции и, возможно, ещё большие доходы.
История выглядит диковато, причём не только для нас с вами, но и для самих участников. Но здесь мало что можно сделать: так инновационная экономика стимулирует инвестиции и людей, так появляются технологии на основе фундаментальных разработок. И понятно, почему нам не хотели давать комментарии: тяжба в самом разгаре и продлится, как обещают юристы, не один год.
Однако, технология технологией, а в фундаментальных исследованиях «криспера» приняли участие множество людей, научных групп, университетов.
— Общая ситуация, которая имеет место в науке всегда, такая: никто не может сказать, что он единолично что-то открыл, — говорит Евгений Кунин. — Всегда есть и предшественники, и дальнейшие исследования. Конкретно повторы CRISPR открыла никому не известная японская лаборатория в 87-м году. Прошло много лет, начали появляться расшифровки геномов и становилось понятно, что эти повторы ассоциированы с некоторыми интересными генами. Тут уже подключились мы, я и моя группа, и в 2002-м опубликовали статью, где подробно рассматривали эти гены. Предложили гипотезу, которая была не совсем верной. Имела отношение к реальности, но не прямое… Прошло около трёх лет, и независимо в трёх лабораториях во Франции и Голландии обнаружили, что часть повторов CRISPR идентична фрагментам ДНК вирусов и плазмид. В двух из этих работ авторы предположили, что эта система может быть формой защиты от чужеродных ДНК. Мы с коллегами сопоставили факты и выдвинули подробную гипотезу, как это всё может работать. Опубликовали весной 2006 года, и она стимулировала решающие эксперименты. В 2007 году микробиологи из корпорации Danisco (производитель йогуртов) опубликовали статью, где нашу гипотезу прямо проверили и подтвердили. У них работа с бактериями была очень хорошо поставлена, и они быстро показали: действительно, когда вы заражаете бактерии вирусом, некоторые выживают и становятся иммунны. И у этих иммунных бактерий в CRISPR вставлен кусок ДНК бактериофага. Это был решающий эксперимент. Исследования стали интенсивнее, и в какой-то момент стало ясно, что некоторые варианты этих систем позволяют очень удобно модифицировать геномы. И от того пошла нынешняя революция в биотехнологиях.
Так что на вопрос, кто это открыл, ответить невозможно. Хотя если припереть меня к стенке и заставить отвечать, я бы сказал, что это были микробиологи из Danisco.
Это не магия
Неизвестно, чем закончатся эксперименты с репродуктивными клетками человека, но в любом случае перспективы у системы CRISPR/Cas9 отличные. И в фундаментальных исследованиях, и в биотехнологии, и в медицине.
— Я думаю, что в медицине эту систему будут применять прежде всего для лечения болезней крови, — говорит Константин Северинов. — Есть несколько вариантов. Например, как сейчас лечат заболевания типа лейкемии? Облучают человека радиацией или отправляют на химиотерапию, чтобы убить его собственные стволовые клетки крови, включая больные, а потом подсаживают стволовые клетки от донора. Но ведь гораздо удобнее выделить стволовые клетки самого пациента, отредактировать их, а потом ввести их обратно после химиотерапии или облучения. И проблема поиска донора снимается, а это очень серьёзная проблема, особенно в России. Мне кажется, такого рода вещи будут первыми, но есть ведь ещё множество приложений вне медицины.
— Понятно, что перспективы самые яркие, — подтверждает Евгений Кунин. — В природе ещё очень много вариантов таких систем. Мы сейчас пытаемся их открывать. Но чтобы делать геномную инженерию, нужно больше, чем только такая система, это ведь не магия. Это прекрасный инструмент, который ещё долгое время будет быстро прогрессировать. В ближайшие несколько лет — наверняка. А потом, как всё на свете, выйдет на насыщение. Это закон эволюции.
Опубликовано в журнале «Кот Шрёдингера» №6 (08) за июнь 2015 г.